
Учебник Органическая химия Щеголев 2016
.pdf
|
|
|
+ |
|
NH2 |
NH2 |
NH3 |
|
H+ |
|
H+ |
|
+ |
|
+ |
N |
N |
|
N |
|
H |
|
H |
Алкилирование аминопиридинов протекает по кольцевому атому азота, а ацилирование — по азоту аминогруппы. Все аминопиридины легко вступают в SE-реакции по кольцу, причѐм место вступления электрофила определяется ориентацией аминогруппы.
-Аминопиридин при взаимодействии с азотистой кислотой превращается в соответствующую соль диазония. В случае - и -амино-пиридинов соли диазония легко гидролизуются в пиридоны. Причиной тому можно считать высокие эффективные положительные заряды на - и -атомах пиридинового кольца, создаваемые акцепторным влиянием азота, что в свою очередь приводит к дестабилизации катиона диазония. Здесь, как и в гидроксильных производных пиридина, -изомер в большей степени проявляет свойства функциональных производных ароматического ряда, чем - и - производные.
Свойства галогенопроизводных пиридина также в значительной степени зависят от положения атома галогена в пиридиновом кольце. В - и - положениях нуклеофильное замещение протекает значительно легче (возможна прямая нуклеофильная атака по этим атомам углерода — механизм SN2), а галоген в -положении, как и в неактивированном бензольном кольце, может замещаться только в очень жѐстких условиях, по ариновому механизму. Например, для 2,3-дихлорпиридина нагревание с метиламином даѐт исключительно продукт замещения по -атому:
|
Cl |
|
|
Cl |
- |
||
|
|
:NH2CH3/ T |
|
|
+ |
||
|
+ |
|
|
|
|
+ [NH3CH3] |
Cl |
|
|
|
|
|
|||
N Cl |
|
N NH-CH3 |
|
||||
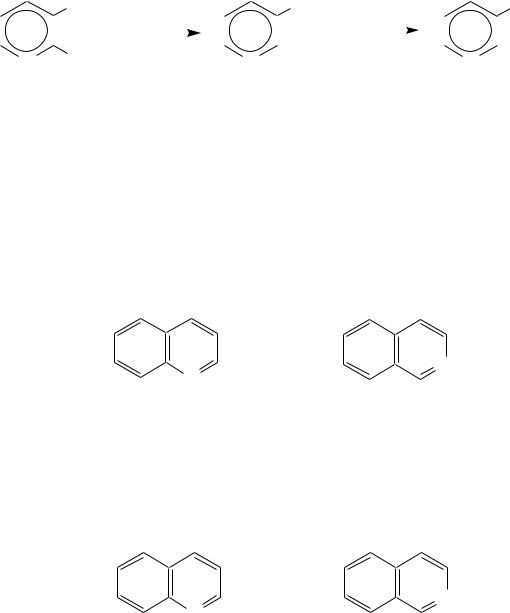
Пиридинкарбоновые кислоты (пиколиновая, никотиновая и изоникотиновая) во многом представляют собой типичные ароматические карбоновые кислоты. Однако из-за наличия в их молекулах атома азота в качестве основного центра они могут существовать и в виде внутренней соли (как типичные аминокислоты).
Различия в свойствах карбоксильных групп, находящихся в различных положениях пиридинового цикла, проявляются по отношению к нагреванию, и это можно проиллюстрировать следующим примером:
661
|
COOH |
|
|
|
COOH |
|
|
|
|||||||||
|
|
|
COOH |
|
|
|
|
|
|
|
COOH |
|
|
COOH |
|||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
450 K |
|
|
|
|
|
|
|
|
510 K |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-CO2 |
|
|
|
|
|
|
|
|
-CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
N COOH |
2 |
|
|
N |
|
N |
||||||||||
|
|
|
|
|
|||||||||||||
пиридин-2,3,4-трикарбоновая |
пиридин-3,4-дикарбоновая |
никотиновая |
|||||||||||||||
|
кислота |
|
(цинхомеровая) |
кислота |
|||||||||||||
|
|
|
|
|
|
кислота |
|
|
|
||||||||
12.4.5. ХИНОЛИН И ИЗОХИНОЛИН
Хинолин и изохинолин — это конденсированные системы, состоящие из пиридинового цикла и бензольного кольца. Поэтому их названия как конденсированных систем:
ba |
cb a N |
N |
|
хинолин |
изохинолин |
(бензо[b]азин) |
(бензо[c]азин) |
Хинолин и изохинолин являются азотоаналогами нафталина, и нумерация атомов в их молекулах проводится так же, как и в молекуле нафталина: в хинолине, начиная с гетероатома, а в изохинолине атом азота имеет номер 2.
5 |
4 |
5 |
4 |
6 |
3 |
6 |
3 |
|
|
7 |
N |
2 |
7 |
N 2 |
|
||||
8 |
|
8 |
1 |
|
1 |
|
Хинолин, изохинолин и их производные — это бесцветные жидкости и низкоплавкие вещества, малорастворимые в воде и имеющие своеобразный запах.
12.4.5.1. Строение
Хинолин и изохинолин, так же, как и их углеродный аналог нафталин, представляют бициклические сопряжѐнные системы из 10 -элек-тронов. Присутствие атома азота значительно изменяет распределение электронной плотности. Электроноакцепторное влияние атома азота главным образом распространяется на цикл пиридина. Поэтому электронная плотность на бензольном кольце понижена в незначительной степени, а наибольший положи-
662
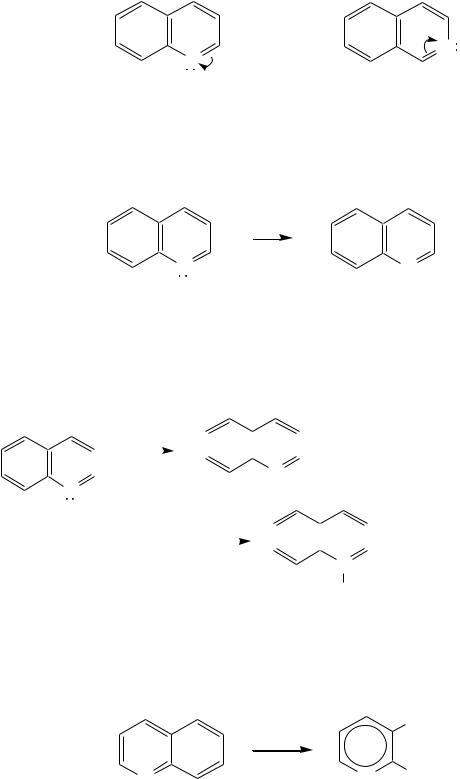
тельный заряд возникает в положении 2 молекулы хинолина и в положении 1 изохинолина:
+ |
N |
N |
+ |
|
12.4.5.2. Химические свойства
Как и пиридин, хинолин и изохинолин являются типичными основаниями с константами основности, близкими к таковым для пиридина. Образование солей протекает аналогично пиридину. Например, для хинолина:
|
HCl |
Cl- |
|
+ |
|
N |
N |
|
H
хлорид хинолиния
Реакции алкилирования и окисления по атому азота протекают в тех же условиях и при участии тех же реагентов, что и для пиридина. Например, для хинолина:
|
|
|
+ RI |
|
|
|
|
|
I- |
|
|
||||
|
|
|
|
|
|
|
|
+ |
|
|
йодид N-алкилхинолиния |
||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||||||
N |
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
H2O2 / CH3COOH |
|
|
|
|
+ |
|
хинолин-N-оксид |
|||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
O -
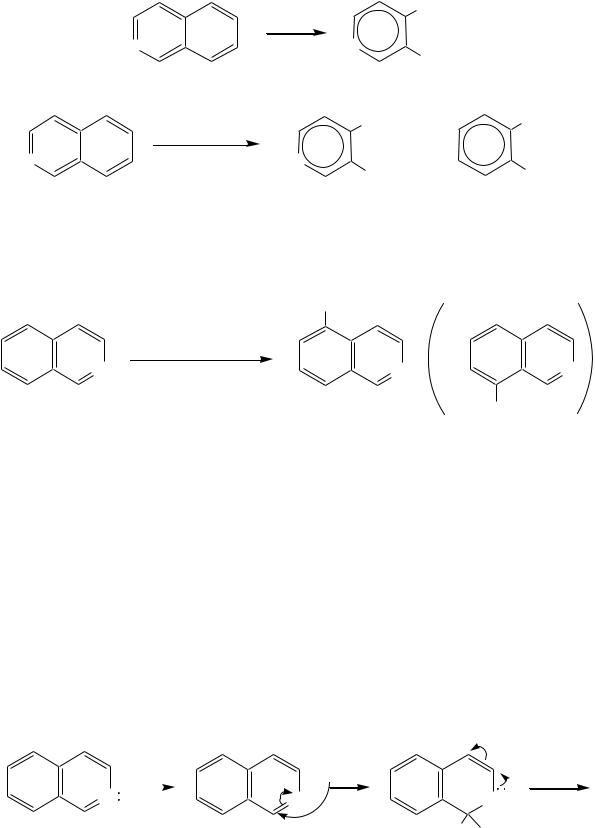
Однако хинолин и изохинолин могут окисляться под действием сильных окислителей (KMnO4, HNO3) с разрушением одного цикла, обычно бензольного. Но окисление изохинолина щелочным раствором перманганата калия приводит к смеси двух кислот.
|
COOH |
|
HNO3,to |
N |
N COOH |
|
хинолиновая кислота |
663
|
HNO3,to |
COOH |
|
|
|
N |
N |
COOH |
|
|
|
|
цинхомеровая кислота |
|
- |
o |
|
COOH |
COOH |
KMnO4 / OH ,t |
|
|
|
+ |
N |
|
N |
|
|
|
COOH |
COOH |
||
|
|
|
Реакции электрофильного замещения для обоих соединений протекают по бензольному кольцу, обычно по атомам С5 и С8. Но если при нитровании хинолина образуется примерно эквимолярная смесь 5- и 8-нит-рохинолинов,
то нитрование изохинолина даѐт преимущественно 5-нитро-производное:
NO2
N |
HNO3 / H2SO4,273 K |
+ |
N |
N |
|
||
|
|
NO2 |
5- |
|
нитроизохинолин |
8-нитроизохинолин |
|
|
90% |
10% |
|
Сульфирование при обычных температурах (90 230 С) также приводит к образованию хинолин-5-сульфокислоты и хинолин-8-сульфокислоты (главным образом, 8-производного), но эти изомеры при нагревании выше 260 С переходят в более термодинамически стабильную 6-сульфоновую кислоту.
Галогенирование хинолина и изохинолина в условиях реакции электрофильного замещения (в присутствии кислотных катализаторов) также приводит к 5- и 8-производным. Введение атома галогена в пиридиновое кольцо происходит в значительно более мягких условиях. Так, бромирование хинолина и изохинолина в присутствии незначительных количеств HCl даѐт 3-бромхинолин и 4-бромизохинолин соответственно. Механизм процесса на примере изохинолина можно представить в следующем виде:
|
|
:Br- |
+ |
- |
HCl |
+ |
Br :Br |
||
N -Cl- |
|
NH -Br- |
|
|
NH |
|
|
||
H Br
664
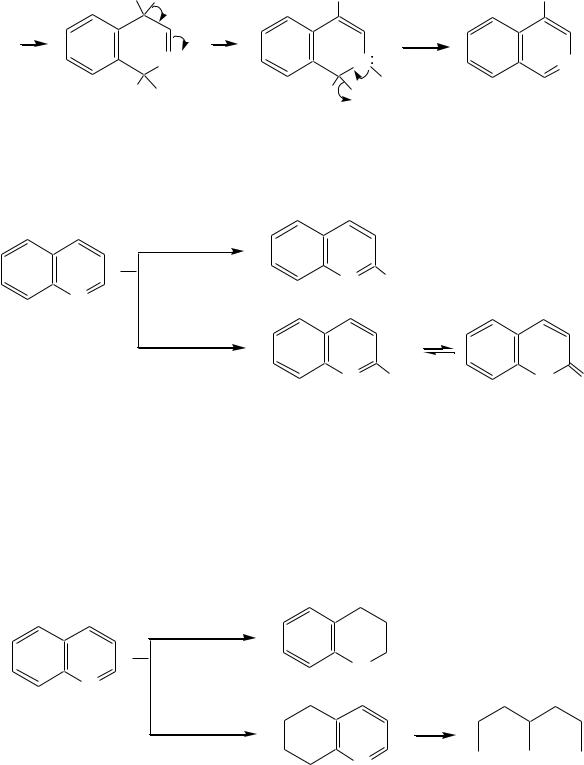
Br |
H |
|
Br |
Br |
|
+ |
-H+ |
|
|
|
NH |
N -HBr |
N |
|
H |
Br |
|
H Br H |
|
4-бромизохинолин
Нуклеофильное замещение атома водорода идѐт наиболее легко в положение С2 хинолина и С1 изохинолина. Так, например, протекают реакция А.Е. Чичибабина и взаимодействие со щѐлочью для хинолина:
NaNH2 / NH3
N NH2
N
KOH,513 K
N OH |
N O |
|
H |
|
хинолин-2-он |
Для хинолина и изохинолина возможно гидрирование как пиридинового цикла, так и бензольного кольца. Восстановить пиридиновый цикл до тетрагидропиридинового можно боргидридами металлов или каталитически водородом в метаноле. Однако каталитическое гидрирование в растворе сильных кислот приводит к первоначальному селективному восстановлению бензольного кольца, а затем — к продукту исчерпывающего гидрирования — декагидропроизводному. Например, для хинолина:
|
H2 / Pt, CH3OH |
|
N |
N |
H |
H2 / Pt, HCl
N 
 N
N 
H
12.4.6. -ПИРАН И -ПИРАН И ИХ ПРОИЗВОДНЫЕ
665
Пираны — это ненасыщенные гетероциклические кислородосодержащие соединения. Возможно существование двух таких изомеров —-пирана и -пирана (или, соответственно 2Н-пиран и 4Н-пиран):
O |
O |
-пиран |
-пиран |
2Н-пиран |
4Н-пиран |
Циклы пиранов содержат один насыщенный атом углерода ( -атом в-пиране и, соответственно, -атом в -пиране), поэтому в их молекулах отсутствует полное циклическое сопряжение и эти соединения не могут относиться к ароматическим.
Пираны широкого распространения и практического использования не имеют. Однако более распространены соли катиона пирилия и оксопроизводные пиранов — пироны:
O
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
O |
|
O O |
|
|
O |
||
пирилий-катион |
-пирон |
-пирон |
|||||||
Строение катиона пирилия подобно строению катиона пиридиния (и молекулы пиридина). Здесь имеет место циклическая сопряжѐнная 6- - электронная система. Отличие от молекулы пиридина — это присутствие в катионе пирилия сильно электроотрицательного атома кислорода в оксониевой форме. Это вызывает сильнейшую поляризацию связей и высокую реакционную способность по отношению к нуклеофилам. Реакции электрофильного замещения для них неизвестны.
Обычно местом нуклеофильной атаки в катионе пирилия является атом С2, но возможны реакции и по атому С4. Присоединение нуклеофила в положение 2 влечѐт за собой, как правило, раскрытие цикла, но возможно последующее его замыкание с образованием другой циклической системы:
R |
R |
|
|
|
R |
|
NH3 / H2O, 293 K |
NH2 |
|
|
|
|
+ |
|
|
H |
|
+ |
-H |
|
H |
O |
|
O |
O |
H |
NH2 |
||
|
|
|
666

|
R |
R |
H |
|
-H2O |
HO |
N |
N |
H |
|
|
|
|
-Пироны являются одновременно -лактонами и сопряжѐнными диенами. Поэтому они проявляют свойства сложных эфиров и вступают, например, в реакцию диенового синтеза как сопряжѐнные диены.
-Пироны способны расщепляться под действием щѐлочи, аммиака, аминов. Местом нуклеофильной атаки является положение 2. Механизм процесса аналогичен приведѐнному выше взаимодействию катиона пирилия с аммиаком.
12.4.7. СПОСОБЫ ПОЛУЧЕНИЯ
Пиридин, хинолин, изохинолин и их метильные производные содержатся в каменноугольной смоле, откуда их выделяют при промышленном получении.
Пиридиновое кольцо входит в структуру многих природных соединений — витаминов, алкалоидов, нуклеиновых кислот, и поэтому некоторые производные пиридина могут быть получены путѐм превращений исходных природных соединений.
Для синтетического получения пиридина, хинолина, изохинолина, их производных, а также кислородосодержащих гетероциклических соединений используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Некоторые примеры таких синтезов.
1. Частично гидрированные алкилпиридины могут быть получены конденсацией -дикарбонильных соединений с аммиаком.
R |
O O + R' |
|
|
|
|
|
H |
||
|
|
|
R |
|
N R' |
||||
C |
C |
|
|
|
|
|
|
|
|
|
+ |
:NH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H2C |
CH2 |
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH2 |
|
|
|
|
|
|
|
|
Реакция начинается как нуклеофильное присоединение аммиака к молекуле дикарбонильного соединения, образованием иминосоединения и затем внутримолекулярное нуклеофильное присоединение с атакой иминогруппы по карбонильной группе.
2. Синтез Ганча представляет собой получение замещѐнных пиридинов конденсацией эфиров -оксокислот с альдегидами и аммиаком.
667
|
O |
|
|
R" + H |
|
|
|
|
|
O |
|
|
|
|
O |
|
R" |
O |
||||||||||||||
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
RO C HC |
CHCH |
C OR |
|||||||||||||
RO |
C |
CH |
|
|
|
CH |
C |
OR |
||||||||||||||||||||||||
|
|
|
O |
+ |
|
|
|
|
|
|
|
+ |
|
+ |
|
|
|
|
:NH3 |
|||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
R |
|
|
|
|
|
|
||||
|
R' C O |
|
|
|
O C R' |
-H2O |
|
R' |
C |
|
|
|
|
|
-2H2O |
|||||||||||||||||
|
|
|
|
|
O O |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
R" |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ROOC |
|
|
|
|
COOR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R' 
 N
N  R'
R'
H
Образовавшийся по данной схеме цикл дигидропиридина может быть далее дегидрирован до пиридинового цикла. Вместо эфира -кетокислот здесь могут быть использованы другие -дикарбонильные соединения (малоновый эфир, ацетилацетон) и эфиры циануксусной кислоты.
3. Пиридин может быть получен циклизацией ацетилена с циановодородом:
2 CH  CH + H C
CH + H C  N
N
N
Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
4. Синтез хинолина по Скраупу* (синтез Скраупа или реакция Скрау-
па) осуществляют, используя первичные ароматические амины, глицерин и концентрированную серную кислоту (60 85%-ю) в присутствии слабых окислителей (нитробензола или соответствующих ароматических нитросоединений или других окислителей).
Первоначально из глицерина под действием серной кислоты образуется акролеин, который затем взаимодействует с ариламином:
|
CH2-CH-CH2 |
|
H2SO4 |
|
|
|
|
|
|
O |
|
|
|
|||
|
|
CH =CH |
C |
+ |
2 H2O |
|||||||||||
|
|
|||||||||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
||||||||||||
OH OH OH |
|
|
|
2 |
|
|
|
H |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
+ |
|
|
|
O - |
|
|
|
|
|
H C O |
|||||
|
|
|
|
|
|
|
|
|||||||||
|
+ CH =CH C |
|
|
|
|
|
|
|
|
|
- |
|
|
|||
|
|
|
|
|
|
|
|
|
|
CH |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
2 |
|
|
H |
|
+ |
|
||||||||
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
NH2 |
CH2 |
||
668
|
|
OH |
- |
+ O |
CH |
H |
C |
CH2 |
|
CH2 |
CH2 -H2O |
NH CH2 |
N |
|
|
|
H |
|
[O] |
|
N |
|
N |
H |
|
|
5. Одним из синтетических способов получения изохинолина является реакция Бишлера*–Напиральского, в которой в качестве исходного используется 2-фенилэтан-1-амин:
CH2 CH2 |
|
|
O |
CH2 |
|
|
|
+ |
R C |
|
CH2 |
|
|||
|
|
X |
R |
|
|||
|
NH2 |
|
|
|
|||
|
|
|
|
|
|
||
|
|
-HX |
C NH |
|
|||
|
|
|
|
||||
|
|
|
|
|
O |
|
|
CH2 CH2 |
P2O5 |
|
|
|
|
|
|
C |
NH |
-HPO3 |
|
N -H2 |
|
N |
|
|
|
|
|||||
R OH |
|
|
R |
|
|
R |
|
|
|
|
|
|
|
||
6. Соли пирилия (производные пирана) обычно получают из , - ненасыщенных карбонильных соединений и метилкетонов в присутствии уксусного ангидрида и сильной кислоты (HClO4) :
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
||
|
|
CH |
|
|
|
|
|
O |
|
|
|
|
|
CH |
|
|
|
|
- |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
HC |
|
|
+ |
|
H3C |
|
C R |
|
|
|
|
HC |
+ |
|
|
+ |
|
|
|
CH2 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O C R |
|
|
||||
R C O |
|
|
|
|
|
|
|
|
|
|
|
R C |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||||
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|||
|
|
CH2 |
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
||||||
CH |
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
CH |
|
|
|||||||||
HC |
|
+ |
|
|
HC |
+ |
|
|
|
|
HC |
|
CH2 |
||||||||||||||
R C |
|
C |
R |
|
R C - |
|
|
C R |
|
|
|
|
|
|
|
|
|
|
R |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
R |
C |
|
|
|
||||||||||
|
|
|
|
|
|
OH |
|
|
|
O |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
OH |
||||||||||||||||||
O |
H |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
669

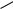 C-NH
C-NH
 C-NH-NH
C-NH-NH