
Учебник Органическая химия Щеголев 2016
.pdf
12.4.1. НОМЕНКЛАТУРА ПИРИДИНА И ЕГО ПРОИЗВОДНЫХ
Систематическое название пиридина — азин (гл. 12.1). Однако как для самого гетероцикла, так и для его производных почти всегда используется тривиальное название «пиридин».
Атомы цикла могут быть обозначены цифровыми локантами или же греческими буквами. Соответственно, возможны три радикала пиридина:
5 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
2 |
|
|
N |
|
|
N |
|
|
N |
||||||
|
|
|
N1 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
-пиридил |
-пиридил |
-пиридил |
||||||||||
|
|
|
|
|
|
|
(пиридин-2-ил) |
(пиридин-3-ил) |
(пиридин-4-ил) |
||||||||||
Метилпроизводные пиридина имеют тривиальное название «пиколины», диметилпроизводные — «лутидины», например:
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N CH3 |
|
|
N |
H C |
N |
CH |
3 |
|||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
-пиколин |
-пиколин |
|
2,6-лутидин |
|
||||||||
(2-метилпиридин) |
(3-метилпиридин) |
(2,6-диметилпиридин) |
||||||||||
-, - и -пиридинкарбоновые кислоты имеют каждая своѐ тривиальное название:
|
|
|
|
|
|
|
|
|
COOH |
||
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
N |
||||
пиколиновая кислота |
никотиновая кислота |
изоникотиновая кислота |
|||||||||
(пиридин-2-карбоновая |
(пиридин-3-карбоновая |
(пиридин-4-карбоновая |
|||||||||
|
|
кислота) |
|
|
кислота) |
кислота) |
|||||
651
12.4.3. ХИМИЧЕСКИЕ СВОЙСТВА ПИРИДИНА
Химические свойства пиридина, как следует из его строения, должны быть достаточно многообразны. Это и реакции непосредственно по атому азота (основные свойства, реакции алкилирования, окисления), и реакции с участием ароматического кольца (электрофильное и нуклеофильное замещение, гидрирование).
12.4.3.1. Основность
Пиридин является типичным основанием с рКb = 8.8. Его основность ниже основности аммиака и алифатических аминов, так как неподелѐнная электронная пара пиридинового азота, за счѐт которой происходит взаимодействие с протоном, находится на sp2-гибридной орбитали. Электронная же пара аминного атома азота находится на sp3-гибридной орбитали, поэтому более удалена от ядра и легче взаимодействует с протоном (рКb аммиака равна 4.8, метиламина — 2.3).
С другой стороны, основность пиридина выше основности анилина и ароматических аминов (рКb анилина = 9.4). В молекуле анилина, как и других ароматических аминов, неподелѐнная электронная пара азота участвует в сопряжении с ароматическим кольцом и делокализована, а в молекуле пиридина пара электронов принадлежит только атому азота.
Основные свойства пиридина проявляются как при взаимодействии с кислотами, так и при взаимодействии с водой:
+ |
HCl |
N |
N + Cl- |
|
H |
|
хлорид пиридиния |
+ |
H2O |
N |
N + OH- |
|
H |
|
гидроксид пиридиния |
12.4.3.2. Реакции алкилирования по атому азота
Неподелѐнная электронная пара азота энергетически более доступна для атаки электрофильными агентами, чем сопряжѐнная система ароматического кольца. Однако только с алкилирующими агентами атом азота образу-
653
ет устойчивые продукты взаимодействия. Реакции между пиридином и галогеналканами протекают легко:
+ |
RI |
+ |
|
|
|
N |
|
N I- |
|
|
R |
|
|
йодид N-алкилпиридиния |
По механизму эти реакции — типичные примеры нуклеофильного замещения, в которых пиридин является нуклеофилом.
Но при нагревании до 200 300 С продукт алкилирования по азоту претерпевает перегруппировку Ладенбурга, протекающую по радикальному механизму, с выбросом галогеноводорода. Результатом этого является образование - и -алкилпиридинов:
|
|
|
|
R |
|
|
to |
|
|
+ |
- |
-HI |
R |
+ |
N I |
|
|||
|
N |
N |
||
|
|
|||
R |
|
|
|
|
В смеси преобладает, как правило, -изомер. Катализаторами могут быть Cu2Cl2, AlCl3. Для радикалов нормального строения (например, н-пропил) происходит их изомеризация.
12.4.3.3. Реакции электрофильного замещения
В молекуле пиридина имеются два реакционных центра для электрофильной атаки, и, как было сказано выше, легче она должна осуществляться по атому азота. Действительно, большинство электрофилов на первой стадии атакует атом азота, а затем происходит перегруппировка с образованием более прочных связей электрофильных частиц с атомами углерода кольца. При этом электрофильное замещение всегда протекает по-углеродному атому в отсутствие других ориентирующих групп, так как - и -атомы дезактивированы электроноакцепторным влиянием атома азота (см. выше). В целом электрофильное замещение в цикле пиридина протекает в жѐстких условиях (при температурах около 230 300 С). Одним из примеров является реакция хлорирования, которая без катализатора протекает при 200 С, а в присутствии хлорида алюминия — при 100 С. Образование связи C–Cl здесь происходит при действии избытка хлорирующего агента:
654
|
|
Cl [AlCl ]- |
|
Cl |
Cl |
|
|
|
|
|
|||
+ Cl2 |
|
+ |
H |
|
||
|
|
|
|
|
|
|
|
- |
-Cl2 |
- |
|
|
-H+ |
N |
N + Cl |
|
N |
|
N |
|
-AlCl |
|
|||||
|
|
|
|
|
||
Cl
-хлорпиридин
Проведение хлорирования при более высокой температуре (230 С) приводит к смене механизма, в результате чего вместо SE-реакции протекает радикальное замещение (SR) и образуются продукты -замещения:
|
Cl2 / 500 K |
|
|
|
|
|
|
-HCl |
|
Cl |
Cl |
|
Cl |
N |
|
N |
N |
|||
|
|
|
|
|||
|
|
-хлорпиридин |
2,6-дихлорпиридин |
|||
Для проведения электрофильного бромирования требуется использование раствора брома в олеуме при 170 С:
Br
Br2 / H2SO4+SO3/ 400 K
- HBr
N N
-бромпиридин
Проведение бромирования без растворителя при более высокой температуре (500 С) также приводит к смене механизма реакции, в результате протекает радикальное замещение:
|
Br2 / 770 K |
|
|
|
-HBr |
N |
Br |
N |
|
||
|
|
-бромпиридин
Реакции нитрования и сульфирования протекают в сильнокислой среде, поэтому первой стадией этих процессов является протонирование с образованием катиона пиридиния, что в свою очередь ещѐ в большей степени замедляет электрофильное замещение.
При нитровании повышение температуры выше 300 С ( 370 С) приводит к смене механизма с SE на SR. При этом вместо -нитропиридина образуется преимущественно -производное:
655
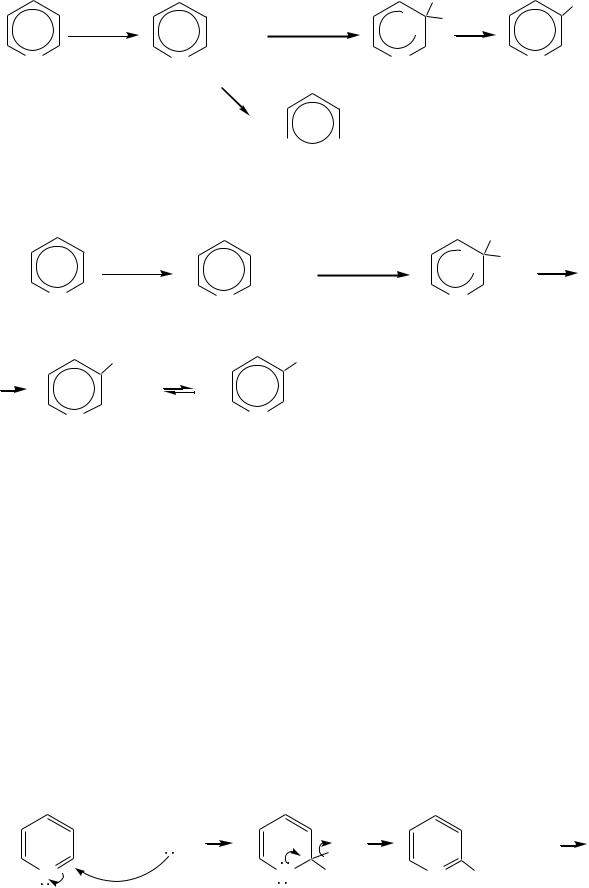
|
|
|
570 K |
NO2 |
NO2 |
|
+ HNO3 |
NO |
H |
|
|
|
NO3- |
2 |
+ |
|
|
|
|
|
|
||
N |
N |
-HNO3 |
N |
-H+ |
|
+ |
|
N |
|||
|
H |
640 K |
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
 N
N 
 NO2
NO2
Сульфирование пиридина при 360 С даѐт -пиридинсульфокислоту, существующую преимущественно в виде внутренней соли:
|
|
|
|
|
|
|
SO3H |
+ H2SO4 |
|
|
|
|
H S O / T |
+ |
H |
|
|
|
|
- |
2 2 7 |
|
|
|
|
|
HSO |
-HSO4- |
|
-H+ |
|
N |
N |
+ |
4 |
|
N |
|
|
|
|
|
|
||||
|
H |
|
|
|
|
|
|
SO H |
|
|
|
SO |
- |
|
|
3 |
|
|
|
3 |
|
|
|
|
|
|
+ |
|
|
|
|
N |
|
|
N |
|
|
|
|
|
|
|
H |
|
|
|
|
Некоторые другие типичные реакции электрофильного замещения, например, реакции алкилирования и ацилирования по Фриделю–Крафтсу, вовсе не характерны для пиридина, но такие реакции невозможны и для производных бензола с сильными электроноакцепторными группами (например, для нитробензола).
12.4.3.4. Реакции нуклеофильного замещения
Наличие атома азота в ароматическом кольце пиридина существенно понижает -электронную плотность, и становится возможной нуклеофильная атака по атому углерода в -положении (и в меньшей степени в-положении). Тем не менее, пиридин и его гомологи реагируют только с сильными нуклеофильными агентами.
Щѐлочи реагируют с пиридином только при температуре около 400 С с образованием -гидроксипиридина, который таутомеризуется в -пиридон. Механизм реакции — SN2аром.:
+ K+ -OH |
- |
H |
+ KH |
+ |
OH |
|
|
N |
N |
N OH |
|
|
K |
+ |
|
|
|
656 |
|
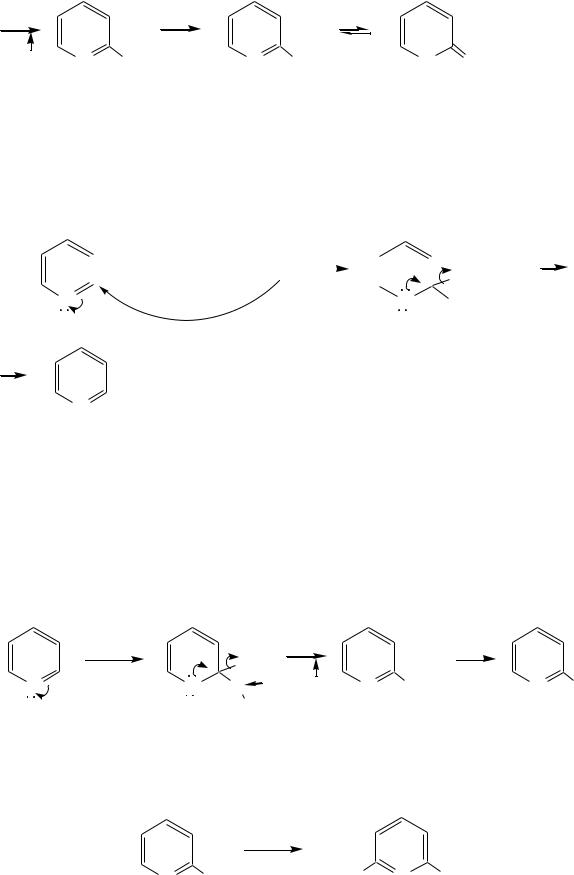
|
|
H+ |
|
-H2 |
|
-K+ |
|
N |
OK |
N OH |
N O |
|
|
|
H |
|
|
-гидроксипиридин |
-пиридон |
Алкилирование и арилирование проводятся литийорганическими соединениями R-Li или Ar-Li при температуре 100 С. Эти реакции также селективно приводят к образованию -замещѐнных пиридинов. Например, взаимодействие с бутиллитием осуществляется по следующей схеме:
|
- |
|
|
|
|
|
|
|
+ CH3CH2CH2CH2: Li + |
|
|
|
|
|
H |
|
|
|
|
|
|
||
|
+ |
|
|
- |
|
||
|
|
|
|
||||
N |
|
|
|
N (CH2)3CH3 |
|||
|
|
|
|
|
|
Li+ |
|
+ LiH
N  (CH2)3CH3
(CH2)3CH3
-бутилпиридин
Для отщепления гидрид-иона на стадии превращения -комплекса в продукты реакции может быть использовано окисление кислородом воздуха; тогда вместо гидрида лития образуется LiOH.
Аминирование пиридина и родственных гетероциклических соединений (реакция А.Е. Чичибабина*) осуществляется амидом натрия в апротонных растворителях при 100 С (или в жидком аммиаке при -33 С). Замещение осуществляется селективно в -положение.
|
NaNH2 |
|
H |
|
|
H2O |
|
+ |
- |
|
-H2 |
- |
-NaOH |
|
|
|
N H |
N NH2 |
|||||
N |
N |
+ |
|
N NHNa+ |
|||
|
|
H |
|
|
|
|
|
|
Na |
|
|
|
|
||
Но если оба -положения заняты, то замещается водород в -положении. При нагревании с избытком амида натрия можно получить пиридин-2,6- диамин.
|
|
NaNH2 |
N |
NH |
H N N NH2 |
|
2 |
2 |
|
|
657 |
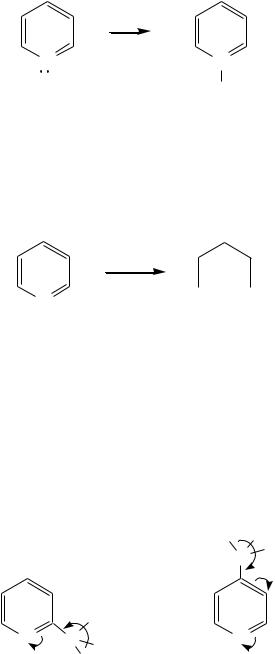
12.4.3.5. Реакции окисления и восстановления
Пиридиновый цикл устойчив к окислителям. Окисление может протекать по атому азота, например, действием пероксида водорода или пероксикислот (H2SO5):
[O]
+
N N O-
пиридин-N-оксид
Восстановление пиридина водородом на никелевом катализаторе приводит к полному гидрированию цикла. Реакция гидрирования пиридина протекает трудно, в условиях, аналогичных гидрированию бензола
(гл. 9.5.1.2).
[H]
N  N
N  H
H
пиперидин
12.4.4.ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ПИКОЛИНОВ И ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ ПИРИДИНА
Пиколины с метильной группой в - и -положениях обладают повышенной СН-кислотностью за счѐт акцепторного влияния атома азота:
|
|
|
H |
|
H |
|
|
|
|
C |
H |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
+ |
|
+ |
H |
|
|
N |
C |
+ |
N |
+ |
|
|
H |
|
|||
|
|
H |
|
|
|
|
-пиколин |
-пиколин |
|||
Это проявляется при образовании ими металлорганических соединений, например, при взаимодействии с бутиллитием, которые затем могут быть использованы в качестве реагентов в нуклеофильных реакциях:
658
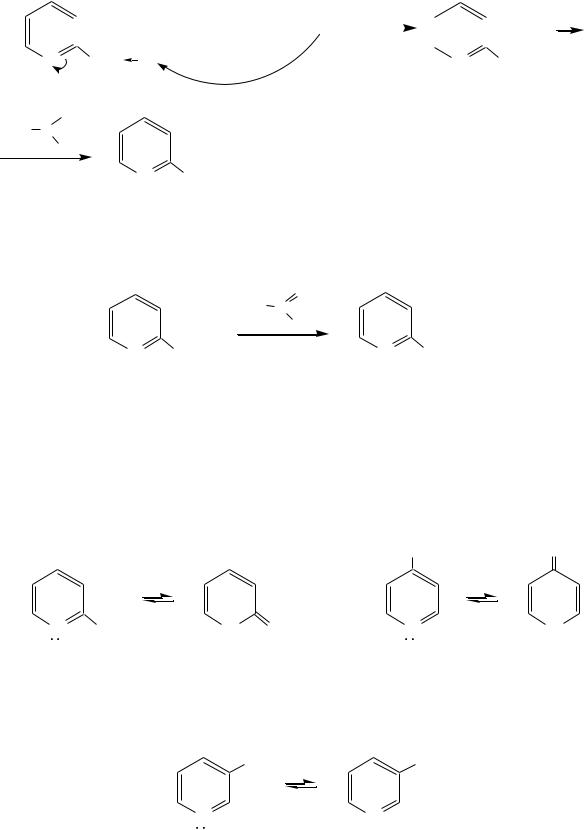
|
|
|
|
+ CH3CH2CH2CH2: Li |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
-C4H10 |
|
|
|
||
|
|
|
|
|
|
|
|
|||
N CH2 |
|
H |
|
|
|
|
|
N CH2Li |
||
|
|
|
|
|||||||
O
H C  H
H
N CH2CH2OLi
или же сами - и -метилпиридины могут вступать в реакции нуклеофильного присоединения с альдегидами в присутствии оснóвного (реже кислотного) катализатора:
|
O |
R |
C |
|
H |
N CH3 |
N CH=CH-R |
Кислотные свойства -пиколина близки к таковым для толуола, и в целом химические свойства -изомера с участием метильной группы аналогичны свойствам толуола.
Из гидроксипиридинов - и -изомеры в обычных условиях существуют в виде - и -пиридонов, образующихся в результате таутомерных превращений:
OH O
N OH |
N O |
N |
N |
|
H |
|
H |
-гидроксипиридин |
-пиридон |
-гидроксипиридин |
-пиридон |
а -изомер существует в равновесии с биполярной формой (в водном растворе обе формы находятся примерно в равных количествах):
OH |
O- |
|
+ |
N |
N |
|
H |
-гидроксипиридин |
|
659
Все гидроксипиридины являются слабыми основаниями и слабыми кислотами. В наибольшей степени кислотные свойства проявляются у-изомера (рКа = 8.7), для него характерны типичные свойства фенолов (нитруется и бромируется легко, реагирует с формальдегидом, с солями диазония — SE-реакции идут преимущественно в положение 2).
Кислотные свойства - и -изомеров выражены значительно слабее (рКа 11), для них становятся возможны реакции спиртов, не характерные для фенолов, в частности, замещение гидроксогруппы в 2-гидрокси- пиридине (или, что то же самое, атома кислорода в 2-пиридоне):
|
POCl3/T |
|
|
|
H2O |
|
|
|
|
- |
+ |
|
OPOCl2 |
-2HCl |
|
|
|
N O |
OPOCl2 |
N Cl |
-HPO3 |
N |
Cl |
|||
N |
||||||||
|
|
|||||||
H |
|
H |
Cl- |
H |
|
|
|
|
|
|
|
|
|
Алкилирование гидроксипиридинов может протекать по атому азота (например, CH3I, (CH3)2SO4) или по атому кислорода (например, диазомета-
ном CH2N2).
Все изомерные аминопиридины проявляют оснóвные свойства в большей степени, чем незамещѐнный пиридин, и образуют при протонировании по кольцевому атому азота кристаллические соли. Производные пиридина с аминогруппами в - и -положениях одноосновны, так как положительный заряд делокализуется между двумя атомами азота, что препятствует повторному протонированию.
|
|
|
|
H+ |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
pKb = 6.8 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
N NH2 |
|
|
|
|
|
|
|
|
|
|
|
N |
NH2 |
|
|
|
|
|
|
|
N NH2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|||||||
NH2 |
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
NH2 |
|
|
||||||||||
H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pKb = 4.9 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
N |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
N |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|||||||
У -изомера основность выражена слабее, что объясняется отсутствием донорного мезомерного влияния аминогруппы в -положении на кольцевой атом азота (рКb = 7.4), но в сильнокислых средах пиридин-3-амин способен дважды протонироваться с образованием дикатиона.
660

 N
N