
Учебник Органическая химия Щеголев 2016
.pdf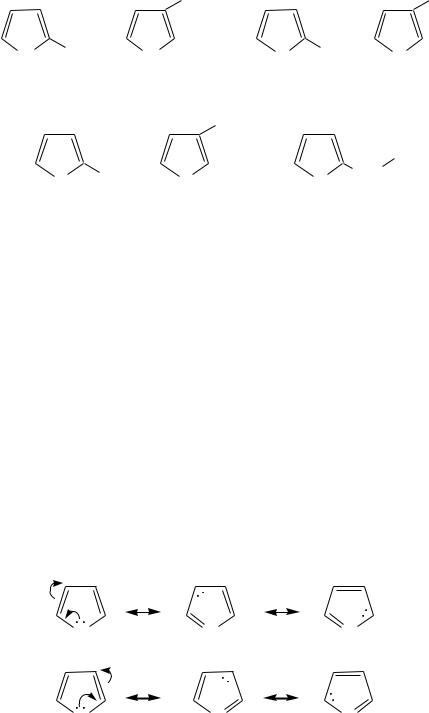
Радикалы, образованные от пиррола, фурана, тиофена и их производных, имеют следующие тривиальные названия:
N |
N |
S |
S |
H |
H |
|
|
-пиррил |
-пиррил |
-тиенил |
-тиенил |
O |
O |
O CH2 |
-фурил |
-фурил |
фурфурил |
12.2.2. СТРОЕНИЕ ПИРРОЛА, ФУРАНА И ТИОФЕНА
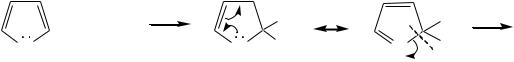
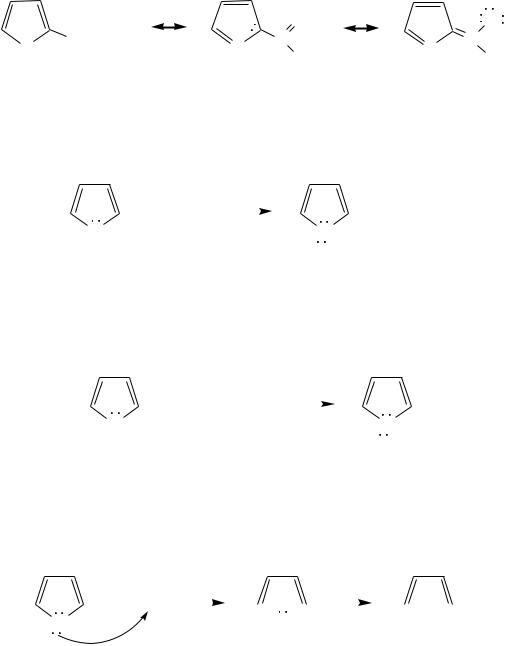
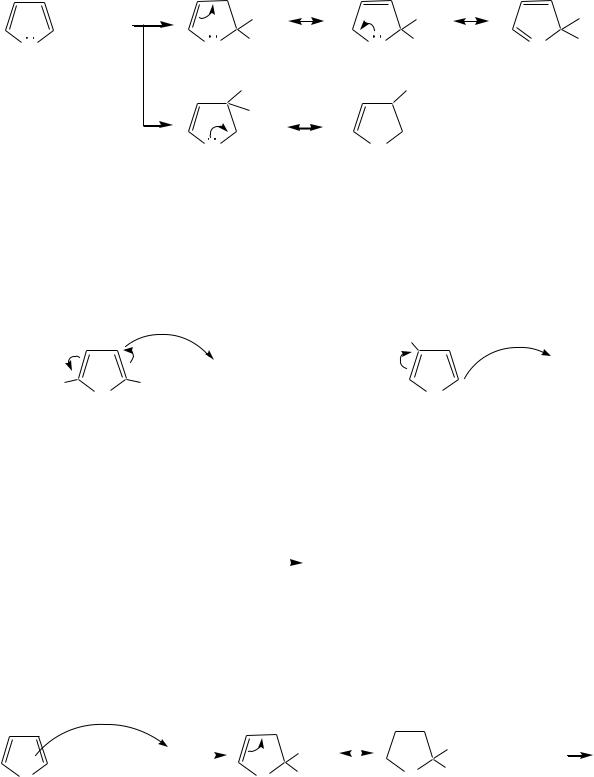
Молекулы пиррола, фурана и тиофена содержат систему сопряжѐнных связей и атом с неподелѐнной электронной парой. В результате образуется циклическая сопряжѐнная система с шестью -электронами (четыре - электрона от двух двойных связей и два — от гетероатома). Поэтому данные соединения имеют ароматический характер.
За счѐт неподелѐнной электронной пары гетероатом в этом кольце является электронодонором, на углеродных атомах электронная плотность повышена (по сравнению с бензолом), и пятичленные гетероциклы в целом являются -избыточными ароматическими системами. Циклическую делокализацию неподелѐнной пары электронов гетероатома можно показать с помощью граничных структур:
|
- |
|
|
|
+ |
+ |
- |
|
|
||
X |
X |
X |
|
|
|
- |
|
|
+ |
- |
+ |
|
|
||
X |
X |
|
X |
Квантово-химическими расчѐтами показано, что величина электронной плотности в -положении больше, чем в -положении.
В пространстве молекула такого соединения представляет плоский пятиугольник, однако длины связей и валентные углы неодинаковы. Это связано с неравномерностью распределения -электронной плотности в кольце и
621
зависит от природы гетероатома. Чем электроотрицательнее гетероатом, тем более неравномерно распределена электронная плотность и, следовательно, меньшей ароматичностью обладает система. Поэтому ряд уменьшения ароматичности (по сравнению с бензолом) можно показать следующим образом (в скобках приведена энергия делокализации ароматической системы в
кДж/моль):
бензол (151) > тиофен (122) > пиррол (90) > фуран (68).
12.2.3.ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ПИРРОЛА, ФУРАНА И ТИОФЕНА
Пиррол, фуран и тиофен являются бесцветными жидкостями с приятным запахом, практически нерастворимы в воде.
Химические свойства пятичленных гетероциклических соединений определяются как наличием ароматического цикла, так и наличием гетероатома.
12.2.3.1. Кислотно-оснόвные свойства
Пиррол, фуран и тиофен взаимодействуют с сильными кислотами. В случае пиррола, фурана и их алкилпроизводных обычно происходит «осмоление» (олигомеризация и полимеризация), тиофеновое кольцо к разрушению под действием холодных кислот устойчиво. Данное свойство пиррола, фурана и отчасти тиофена и их производных называется ацидофобностью. Ацидофобность связана с присоединением протона в большинстве случаев к-углеродному атому, разрушением ароматической системы и дальнейшим превращением активной диеновой системы:
|
+ |
|
|
|
|
+ H+ |
H |
+ |
H |
. . . |
|
X |
X H |
H |
|||
X |
|
Наибольшей основностью обладает пиррол, он легче всего протонируется. Самым слабым основанием из рассматриваемых гетероциклов является тиофен, он наиболее трудно протонируется, поэтому он наименее ацидофобен.
Введение в молекулу электроноакцепторных заместителей уменьшает электронную плотность на ароматическом кольце и тем самым снижает ацидофобность. При наличии сильных электроноакцепторов в гетероциклическом кольце соединение может и вовсе быть устойчиво к действию кислот, как, например, молекула пирослизевой кислоты:
622
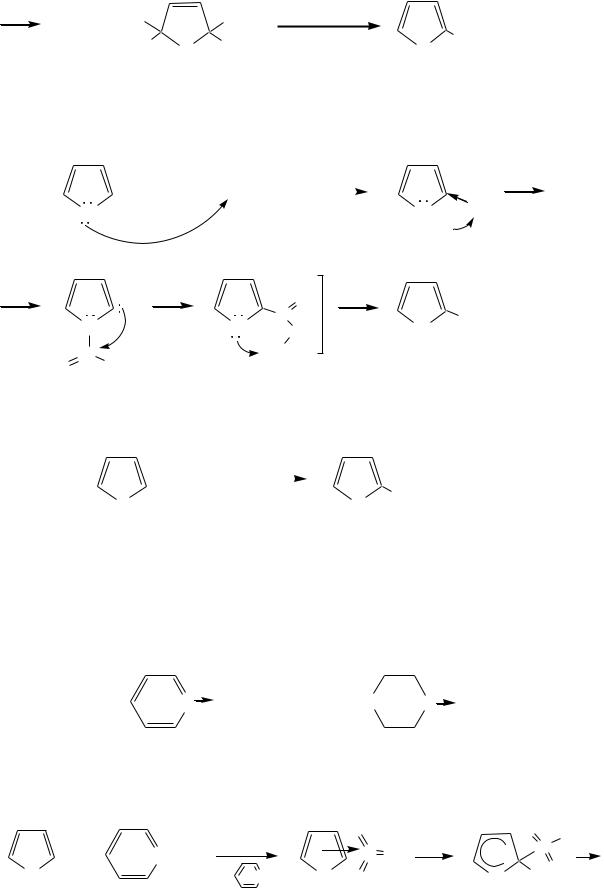
CH COO |
NO2 |
|
|
|
3 |
|
|
|
|
H |
O H |
-CH3COOH |
O |
NO |
|
2 |
|||
|
|
|
|
2-нитрофуран
-Нитропиррол в отличие от нитропроизводных фурана и тиофена получают через соли пиррола. Например, при использовании этилнитрата:
|
|
+ |
|
|
|
|
|
|
- |
|
+ H5C2O-NO2 |
|
|
|
|
|
|
|
|
-C2H5OK |
|
|
|
H |
||
N |
K+ |
|
|
|
|
N |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
- |
- |
+ |
O |
|
|
|
|
N |
|
|
NO2 |
||
N |
N |
O |
N |
|||
|
|
|||||
+ |
|
H |
|
H |
|
|
O N OH |
|
|
|
|||
|
|
|
|
|
2-нитропиррол
Сульфировать серной кислотой можно только тиофен:
+ H2SO4 |
|
|
+ H2O |
|
|
||
S |
|
S SO3H |
|
|
|
тиофен-2-сульфокислота |
|
(Механизм сульфирования здесь такой же, как и механизм взаимодействия с холодной концентрированной серной кислотой бензола и его производных.)
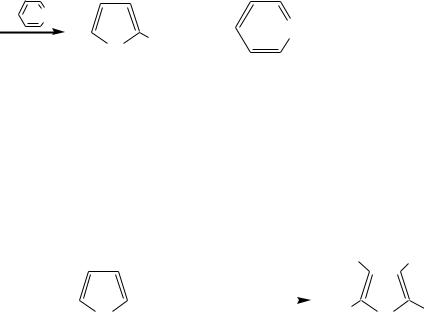
Для сульфирования пиррола и фурана по причине их ацидофобности используют комплексы триоксида серы с электронодонорами, обычно пиридинсульфотриоксид или диоксансульфотриоксид:
N SO3 |
O |
O SO3 |
пиридинсульфотриоксид |
диоксансульфотриоксид |
|
Механизм сульфирования такими комплексами аналогичен механизму сульфирования триоксидом серы:
|
|
O + |
|
|
O |
O- |
+ |
N: SO3 |
S |
O |
+ |
S |
|
|
|
|||||
|
|
|
|
|
|
|
X |
- N: |
X O |
|
X H O |
|
|
|
|
625 |
|
|
|
|
N: |
|
|
+ |
|
SO |
- + |
NH |
X |
|
||
3 |
|
||
Пиридин (или диоксан) в качестве донора электронной пары необходим для связывания отщепляющегося протона.
Галогенирование (хлорирование, бромирование, йодирование) пиррола и тиофена протекает настолько легко, что если специальным образом не контролировать течение реакции, образуются тетрагалогенопроизводные. Так, например, бромирование пиррола раствором брома в этаноле при 0 С даѐт тетрабромпиррол:
|
|
|
|
|
Br |
|
Br |
|
|
+ 4Br2 |
C2H5OH |
|
|
+ 4HBr |
|||
|
|
|
||||||
N |
|
|
|
Br |
N |
Br |
||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
H |
|
|
|
|
|
H |
|
|
Получение монобромпиррола ( -изомер) представляет определѐнную трудность, и для этих целей обычно используют специальные бромирующие агенты. Для получения монобромтиофена применяют достаточно низкие температуры (-5 -15 С). Для хлорирования используют сульфурилхлорид SO2Cl2 или тетрахлорид олова SnCl4. Йодирование осуществляется молекулярным йодом (или KI + H2O2) в присутствии кислотного катализатора.
Галогенирование фурана протекает через реакцию присоединения (с последующим отщеплением галогеноводорода) — в этом проявляется диеновый характер этого гетероцикла. Здесь возможно хлорирование (газообразным хлором) или бромирование с образованием полигалогенопроизводных, но не йодирование. Фуран не реагирует с йодом.
Ацилирование пиррола, фурана и тиофена осуществляют ангидридами (реже галогенангидридами) карбоновых кислот.
Алкилирование фурана и пиррола не проводят, так как вероятные продукты этой реакции ещѐ более ацидофобны и полимеризуются за счѐт выделяющегося галогеноводорода.
Высокая активность пиррола иллюстрируется его способностью реагировать со слабыми электрофилами, например с солями арендиазония, диоксидом углерода, альдегидами. Скорость азосочетания сильно зависит от рН среды. При значениях рН ниже 8 в реакцию сочетания с катионом бензолдиазония вступает нейтральная молекула пиррола, а при значениях рН раствора выше 10 в реакции участвует пирролид-анион, и она в этом случае протекает в 108 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.
626
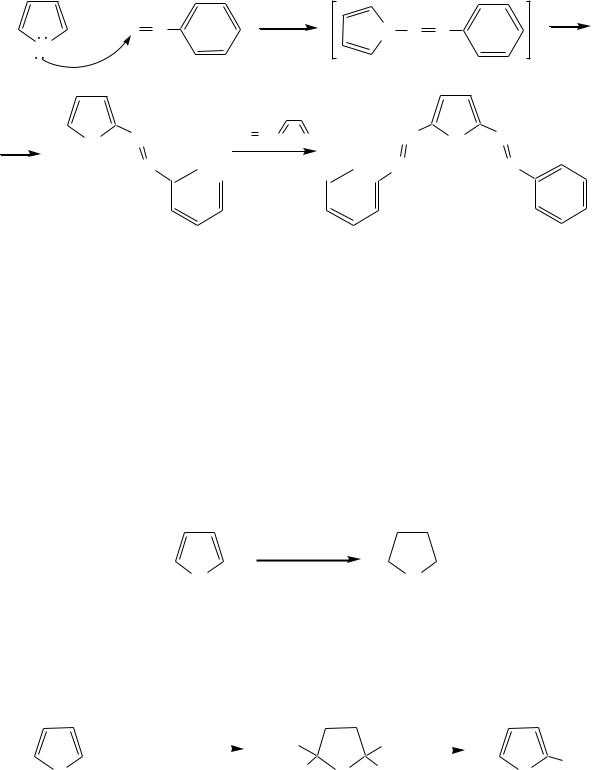
- |
+ |
+ |
273 K |
N N N |
N N |
|
N
+
N N N N 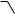
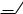 N N N
N N N
H N 

 N H N
N H N
Взаимодействие пирролида калия с диоксидом углерода протекает по механизму, аналогичному реакции Кольбе–Шмитта (гл. 10.5.3.3), с образованием пиррол-2-карбоновой кислоты.
12.2.3.3. Реакции присоединения
В этих реакциях проявляется диеновый характер гетероциклов. Поэтому такие реакции наиболее характерны для фурана. Примерами могут быть присоединение водорода, галогенов и реакция диенового синтеза.
Водород присоединяется в присутствии катализаторов (Ni, Pd, Pt) при нагревании и под давлением. Из пиррола, фурана и тиофена образуются соответствующие тетрагидропроизводные — пирролидин, тетрагидрофуран и тиофан:
H2 / kat, P, T
X X
(X = NR, O, S)
Труднее всех гидрируется тиофен и его производные, а легче — фуран. Присоединение галогенов наиболее характерно для фурана, причѐм
продукт присоединения может отщеплять молекулу галогеноводорода, давая продукт формального замещения, например:
+ |
Br2 |
|
|
Br |
|
Br |
|
|
|
|
Br |
|
|
H |
O H |
- HBr |
|
||||||
O |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
2,5-дибром-2,5-дигидрофуран |
2-бромфуран |
||||||
Реакции диенового синтеза характерны, главным образом, для фурана. Это, например, взаимодействие с малеиновым ангидридом:
627
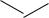

 ba N
ba N
H
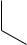
Нумерацию атомов в индоле начинают с гетероатома, атомы углерода в пиррольном цикле могут быть обозначены также греческими буквами:
|
4 |
3 |
|
|
|
||
5 |
|
|
|
|
|
2 |
|
6 |
|
N |
1 |
|
7 |
||
|
H |
|
|
|
|
|
|
Индол и его производные — это бесцветные кристаллические вещества, не растворяющиеся в воде и имеющие своеобразный неприятный запах.
12.2.4.1. Строение
Молекула индола представляет 10- -электронную бициклическую сопряжѐнную систему, в которой участвует гетероатом со своей неподелѐнной электронной парой. В результате электронодонорного мезомерного эффекта атома азота повышается электронная плотность в положениях 3, 5 и 7:
-
-
 N- H
N- H
12.2.4.2. Кислотно-осόвные свойства
Сильные кислоты протонируют индол в положение 3, тем самым нарушается сопряжѐнная система пиррольного цикла, что приводит к его раскрытию и дальнейшим превращениям (димеризация, олигомеризация):
- |
H |
H |
H |
H |
|
|
|
|
|
|
+ H+ |
+ |
+ |
. . . |
N |
|
|
||
N |
|
N |
|
|
H |
H |
|
H |
|
Индол является слабой NH-кислотой (по кислотности сравним с пирролом). Он образует соли при действии щелочей, алкоголятов и металлорганических соединений (аналогично пирролу).
630

 N
N 

 N
N 

 H
H

 CN
CN
 CN CN
CN CN