
- •2.Квантомеханическая теория строения атома. Уравнение Шредингера. Волновая функция. Радиальная и угловая составляющие. Квантовые числа. Атомные уровни, подуровни и орбитали. Формы s-,p-,d- орбиталей.
- •11. Термодинамические функции состояния: энергия Гиббса и энергия Гельмгольца. Критерии самопроизвольного протекания процессов. Способы расчета изменеия энергии Гиббса в ходе химической реакции.
- •17. Особенности кинетики гетерогенных химических реакций. Стадии процесса и области его протекания. Кинетика процесса в кинетической и диффузионной областях. Закон Фика.
- •18. Адсорбция, виды адсорбции( физическая, химическая, активированная). Изотерма адсорбции Ленгмюра.
- •19. Понятие о гомогенном катализе. Механизм действие катализатора. Энергетические диаграммы для некаталитической и каталитической реакции.
- •20. Понятие о гетерогенном катализе. Стадии гетерогенной каталитической реакции. Роль адсорбции в гетерогенном катализе. Энергетическая диаграмма гетерогенной каталитической реакции.
- •21. Растворы. Современные представления о физико-химических процессах образования растворов. Энергетические эффекты при растворении. Ненасыщенные, насыщенные и перенасыщенные растворы.
- •22.Идеальные растворы. Закон Рауля и следствия из него. Фазовые диаграммы воды водного раствора. Понятие об осмосе, уравнение Вант-Гоффа.
- •23. Растворы электролитов. Классическая теория электролитической диссоциации Аррениуса. Степень и константа диссоциации и факторы, влияющие на них. Закон разбавления Оствальда для слабого электролита.
- •25. Электрическая проводимость растворов электролитов: удельная и молярная. Зависимость Кольрауша. Коэффициент электропроводности и степень диссоциации.
- •26. Равновесие в водных растворах слабых электролитов. Диссоциация воды. Ионное произведение воды. Водородный и гидрооксидный показатели.
- •27. Равновесие в системе «трудно растворимый электролит – его насыщенный раствор». Произведение растворимости. Расчетрастворимости соединений по значению пр. Условия образования и растворения осадка.
- •28. Направление протекания реакций с участием электролитов (образование осадка, газа, слабого электролита). Гидролиз солей. Типы реакций гидролиза. Степень и константа гидролиза.
- •30. Классификация электродов. Металлические электроды. Газовые электроды: водородный, кислородный. Зависимость потенциалов водородного и кислородного электродов от рН.
- •31. Гальванические элементы и их классификация. Процессы, протекающие при работе гэ. Расчет эдс и работы гэ. Окислительно – восстановительные и концентрационнные гэ. Определение рН раствора.
- •34. Практическое применение электрохимческих процессов. Химические источники тока. Аккумуляторы. Свинцовый аккумулятор. Топливные элементы. Водородно – кислородный топливный элемент.
- •35. Коррозия. Классификация коррозионных процессов по характеру разрушений, по виду агрессивной среды, по механизму протекания. Скорость равномерной коррозии.
- •36. Химическая коррозия. Высокотемпературная газовая коррозия. Законы роста оксидных пленок. Фактор Пиллинга – Бэдвордса. Коррозия в среде жидких неэлектролитов.
- •43. Диаграмма плавкости бинарной металлической системы с образованием химического соединения. Анализ диаграммы по правилу фаз Гиббса-Коновалова. Понятие об интерметаллидах.
- •45. Жесткость воды.Виды жесткости. Единицы измерения жесткости. Методы устранения жесткости воды.
- •48. Общая характеристика элементов ivа группы. Олово и свинец. Их получение; взаимодействие с кислородом, галогенами, растворами кислот и щелочей. Применение в технике.
- •49. Физические и химические свойства кремния и германия. Собственная и примесная проводимости элементарных полупроводников. Способы получения и методы очистки полупроводниковх материалов.
22.Идеальные растворы. Закон Рауля и следствия из него. Фазовые диаграммы воды водного раствора. Понятие об осмосе, уравнение Вант-Гоффа.
В идеальных растворах сила межмолекулярного взаимодействия однородных и разнородных частиц одинакова, поэтому выполняются следующие условия: при образовании идеального раствора не изменяется объем, внутренняя энергия и энтельпия системы; зависимость химического потенциала компонента от состава идеального раствора имеет вид, аналогичный зависимости химического потенциала компонента идеальной газовой смеси от состава:
Первый
закон Рауля: Относительное понижение
давления пара растворителя равно мольной
доле растворенного вещества: ![]() ,
,
![]() - абсолютное понижение давления.
- абсолютное понижение давления.
Второй закон Рауля:Понижение температуры замерзания или повышение температуры кипения прямопропорционально моляльной концентрации раствора Сm (константа замерзания и кипения – изменение температуры для раствора, содержащего 1 моль вещества на 1000г растворителя): Тз=kзСm, TкипСm
В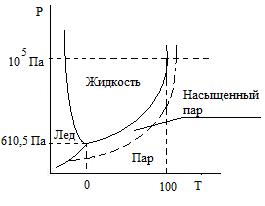 ода
при 0оС
и давлении насыщенного пара 3105
Па образует три фазы, находящиеся в
равновесии. При повышении температуры.
исчезает твердая фаза – лед. а при ее
понижении исчезнет жидая фаза – вода.
В обоих случаях система переходит в
двухфазную. Если построить график в
системе координат р-Т, то мы получим
систему из трех кривых, пересекающихся
в одной точке – тройная точка - ,
соответствующей нонвариантной системе
(число степеней свободы С=0). Пересекающиеся
в этой точке кривые разбивают всю
плоскость на три области: область пара,
жидкости и твердого состояния.
ода
при 0оС
и давлении насыщенного пара 3105
Па образует три фазы, находящиеся в
равновесии. При повышении температуры.
исчезает твердая фаза – лед. а при ее
понижении исчезнет жидая фаза – вода.
В обоих случаях система переходит в
двухфазную. Если построить график в
системе координат р-Т, то мы получим
систему из трех кривых, пересекающихся
в одной точке – тройная точка - ,
соответствующей нонвариантной системе
(число степеней свободы С=0). Пересекающиеся
в этой точке кривые разбивают всю
плоскость на три области: область пара,
жидкости и твердого состояния.
Осмос – односторонняя диффузия, возникающая в растворах при наличии полупроницаемой перегородки, которая может пропускать через себя молекулы растворителя, но не пропускает молекулы растворенного вещества. В результате в раствор, помещенный в сосуд с полупроницаемыми стенками, проникает растворитель, разбавляя его и увеличивая при этом его объем и осмотическое давление. Вант-Гофф предложил для расчета осмотического давления уравнение Клайперона – Менделеева в следующем виде: =СRТ, где - осмотическое давление, С – молярная концентрация, R- газовая постоянная, Т – абсолютная температура.
23. Растворы электролитов. Классическая теория электролитической диссоциации Аррениуса. Степень и константа диссоциации и факторы, влияющие на них. Закон разбавления Оствальда для слабого электролита.
Электролиты
– вещества, растворы или расплавы
которых проводят электрический ток.
Электролитическая диссоциация не
зависит от наличия разности потенциалов,
создающей электрический ток, что
подтверждается своеобразным течением
химических реакций в электролите между
отдельными ионами вне зависимости от
того, из каких веществ эти ионы получены.
По теории Аррениуса степень диссоциации
является основной величиной, определяющей
поведение электролита. Она зависит от
строения молекул растворенного вещества
и связей в них, от природы растворителя
и от его диэлектрической постоянной,
от температуры и от концентрации. Чем
больше диэлектрическая постоянная
растворителя, тем выше степень
электролитической диссоциации. Степень
диссоциации увеличивается с повышением
температуры, так как процесс распада
молекулы происходит с поглощением
энергии (принцип Ле Шателье). Константа
диссоциации вычисляется по равновесным
концентрациям молекул и ионов: Kd(C)=![]() ,
где
,
где![]() ,
,![]() – равновесные молярные концентрации
катионов и анионов соответственно,
– равновесные молярные концентрации
катионов и анионов соответственно, ![]() - равновесная молярная концентрация
недиссоциированных молекул электролита.
Kd(C)=
- равновесная молярная концентрация
недиссоциированных молекул электролита.
Kd(C)=![]() С
– закон разбавления Оствальда. Очевидно,
что степень диссоциации тем больше, чем
ниже концентрация, т.е. чем сильнее
разбавлен раствор.
С
– закон разбавления Оствальда. Очевидно,
что степень диссоциации тем больше, чем
ниже концентрация, т.е. чем сильнее
разбавлен раствор.
24. Закон Рауля для растворов электролитов. Коэффициент диссоциации и его связь со степенью диссоциации. Элементы современной теории сильных электролитов (теория Дебая-Хюккеля). Ионная сила, активность, коэффициент активности.
Законы Рауля были выведены для растворов неэлектролитов. Оказалось, что соли и другие вещества электролиты дают те же результаты.
Диссоциация молекул на ионы оказывает влияние и на осмотическое давление, так как увеличивает число частиц в растворе. Увеличение числа частиц вызывает, при той же исходной концентрации, увеличение осмотического давления. Для растворов электролитов в уравнение закона Вант-Гоффа надо ввести коэффициент диссоциации, учитывающий изменение числа частиц в растворе: =iCRT. Его связь со степенью диссоциации (отношением числа распавшихся на ионы молекул к числу молекул растворяемого вещества) следующим соотношением:
=![]() ,
где х + у – число ионов из одной молекулы.
,
где х + у – число ионов из одной молекулы.
Сильным электролитом называется раствор, в котором степень диссоциации или средний коэффициент активности превышает 0,5 при нормальной концентрации и комнатной температуре раствора.
Электролиты, образованные растворением кристаллов высокой степени ионности, отличаются тем, что в них существование молекул практически исключено. В таких электролитах при предельной. насыщенной концентрации ионы находятся в равновесии не с молекулами. а с кристаллами.В таких растворах уже нельзя рассматривать процесс электролитической диссоциации как обратимый, степень электролитической диссоциации равна единице. Дебай ввел новое понятие для характеристики сильных электролитов – коэффициент активности, который можно рассматривать как меру различия поведения электролита в данном растворе, который принимают за идеальный.
Тогда
активность будет выражаться соотношением
а=C,
где а – активность, С – концентрация
электролита,
– коэффициент активности. Коэффициент
активности увеличивается с повышением
температуры или уменьшением концентрации.
Для идеальных растворов он примерно
равен единице. Методов определения
коэффициентов активности катионов и
анионов нет, поскольку получить раствор,
содержащий только катионы или анионы
невозможно. Поэтому используют понятия
средней ионной активности и среднего
ионного коэффициента активности, которые
связаны соотношением: а±=±Cm±,
Cm±
- Cm![]() , ±=
, ±=![]() ,
а±=
,
а±=![]()
Сила
электростатического взаимодействия
ионов с их окружением (ионной атмосферой)
зависит от концентрации ионов и от того,
какой заряд несут эти ионы. Мерой этого
взаимодействия является ионная сила
раствора I,
расчитываемая по формуле: I=0,5Cm,iZi2,
где Cm,i
– моляльная концентрация i-го
иона,
Zi
– зарядовое число i-го
иона. Средний коэффициент активности
можно расчитать по уравнению предельного
закона Дебая – Хюккеля: lg±=
- AZ1Z2![]() ,
где А – коэффициент, зависящий от
температуры и диэлектрической
проницаемости растворителя (при Т=298К
А=0,509 для разбавленных растворов).
,
где А – коэффициент, зависящий от
температуры и диэлектрической
проницаемости растворителя (при Т=298К
А=0,509 для разбавленных растворов).
