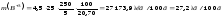Фотоколориметрія
Приклад 1. Обчисліть молярний коефіцієнт світлопоглинання комплексного іона аміакату міді, якщо оптична густина розчину, який міститъ мідь масою 2,0 мг в розчині об'ємом 500,0 мл, складає 0,25. Товщина поглинаючого шару складає 1 см.
Дано: m(Cu) = 2,0 мг = 0,002 г; Vр = 500,0 мл = 0,500 л; l = 1 см.
Знайти: ξ
Розв'язування: Згідно основного закону світлопоглинання молярний коефіцієнт світлопоглинання обчислюємо за формулою:
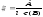
Знайдемо молярну концентрацію розчину за формулою:
 моль/л
моль/л
Молярний коефіцієнт світлопоглинання аміак ату міді дорівнює:
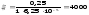
Приклад 2. Із наважки гороху масою 10,0 г отримали розчин хлориду цинку об'ємом 100,0 мл. До аліквоти розчину об'ємом 5,0 мл додали цинкон та довели об'єм розчину дистильованою водою до 50,0 мл. Обчислітъ масову частку (%) цинку в, якщо горохові оптичні густини досліджуваного та стандартного розчину цинку при товщині шару 5 см і довжині хвилі λмакс = 625 нм дорівнюють, відповідно, 0,20 і 0,22. Масова концентрація цинку в стандартному розчині дорівнює 0,4 мг/л.
Дано: m(наважки) = 10,0 г; V1 = 100,0 мл = 0,100 л; Vа = 5 мл; V2 = 50,0 мл;
l = 5 см; ρ(Zn2+)ст. = 0,4 мг/л; Ах = 0,20; Аст = 0,22.
Знайти: ω(Zn2+)
Розв'язування: Запишемо закон світлопоглинання для обох розчинів:
Aх = k·l· ρ(Zn2+)х
Aст = k·l· ρ(Zn2+)ст.
Використовуючи метод порівняння, розділимо праві і ліві частини рівнянь одна на одну

Знаходимо масову концентрацію цинку в розбавленому розчині:
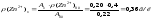
Обчислюємо масу цинку у наважці гороху
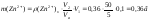
Масова частка цинку у горосі становить:
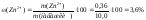
Приклад 3. Оптичні густини еталонного та досліджуваного розчинів речовини по відношенню до стандартного розчину порівняння відповідно дорівнюють 0.175 i 0,150. Масові концентрації еталонного та стандартного розчину порівняння становлять 0,8 г/л та 0,5 г/л, відповідно. Обчисліть масову концентрацію речовини в досліджуваному розчині.
Дано: ΔАет = 0,175; ΔАх = 0,15; ρет = 0,8 г/л; ρст = 0,5 г/л.
Знайти: ρх .
Розв'язування: При проведенні аналізу використано диференційний метод вимірювання оптичної густини.
Запишемо закон світлопоглинання для еталонного та досліджуваного розчинів розчинів:
ΔAет = Aет – Aст = k·l· (ρет - ρст.)
ΔAх = Aх - Aст = k·l· (ρх - ρст.)
Розділимо праві і ліві частини рівнянь одна на одну

Зідси знайдемо масову концентрацію речовини в досліджуваному розчині:
Люмінесцентний аналіз. Фотометрія полум'я
Приклад 4. Для визначення масової частки алюмінію в пшениці з наважки масою 10,0123 г приготували розчин об'ємом 25 мл. До аліквоти розчину об'ємом 10 мл додали водяний розчин кверцетину и об'єм розчину довели водою до 50 мл. Інтенсивність люмінесценції комплексу алюмінію в отриманому розчині склала 25.
Інтенсивність люмінесценції чотирьох стандартних розчинів, що містять алюмінію, дорівнює відповідно.
|
Т(Al), мкг/мл |
2 |
4 |
6 |
8 |
|
Івідн. |
10 |
20 |
30 |
40 |
.
Побудувати градуювальний графік i визначити масову частку (%) алюмінію в пшениці.
Дано: m(пшениці) = 10,0123 г; V1 = 25 мл; Vа = 10 мл; V2 = 50 мл; Іх = 25.
Знайти: ω(Al)
Розв'язування:
Інтенсивність люмінесценції є функцією концентрації алюмінію І = f (ρ(Al)). Будуємо градуювальний графік в координатах І - ρ(Al)
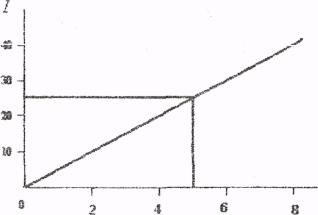
Т(Al), мкг/мл
І - інтенсивність люмінесценції, Т(Al) - титр стандартного розчину алюмінію.
Наносимо на графік величину інтенсивності люмінесценції аналізованого розчину і знаходимо, що титр алюмінія в розчині становить 5,0 мкг/мл, Масову частку (%) алюмінію в пшениці розраховують за формулою
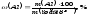
Масу алюмінію обчислюємо за формулою:
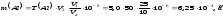
Масова
частка алюмінію в продукті дорівнює

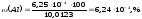
Приклад 5.
Для визначення бору в харчовому продукті методом добавок наважку харчового продукту масою 0,200 г розчинили в дистильованій воді і після відповідної обробки виміряли інтенсившсть люмінесценції отриманого розчину: Iх = 30. Після додавання 40 мкг вітаміну B2 інтенсивність люмінеcцeнції збільшилася до 1х+ст = 80; визначити масову частку вітаміну В2 у продукті.
Дано: m(продукту) = 0,200 г; m(B2)ст = 40 мкг; Iх = 30; 1х+ст = 80
Знайти: ω(B2)
Розв'язування:
Інтенсивність люмінесценції прямо пропорційна масі вітаміну B2 в розчині. Збільшення маси вітаміну на 40 мкг викликало збільшення інтенсивності люмінесценції
ΔІ = 1х+ст. - Iх = 80 - 30 = 50.
Знаходимо масу вітаміну B2 в розчині
m(B2)
= m(B2)ст.· = 40·
= 40·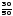 = 24 мкг
= 24 мкг
Знаходимо масову частку вітаміну B2 в продукті
ω(B2)
= m(B2)·
 = 24·10−6
·
= 24·10−6
·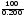 = 1,2·10−2
%
= 1,2·10−2
%
Приклад 6.
Для визначення бору в харчовому продукті методом обмежуючих розчинів з наважки продукту масою
20,70 г приготували розчин об'ємом 250 мл. До аліквоти розчину об'ємом 5 мл додали етанол, буферний розчин i розчин бензоїну. Об'єм довели до 25 мл. Дані щодо люмінесценції аналізуємого та двох стандартних розчинів наведені в таблиці:
|
ρ (В3+), мкг/мл |
х |
1,5 |
2,5 |
|
Івідн. |
30,5 |
27,5 |
38,5 |
Визначити вміст бору у харчовому продукті (мг/100 г).
Дано: m(продукту) = 20,70 г; V1 = 250 мл; Vа = 5 мл; V2 = 25 мл; Знайти: m(В3+), мг/100г
Розв'язування:
Зміна інтенсивності люмінесценції прямо пропорційна зміні концентрації B+3 в розчині. Відповідно, вірним є співвідношення

Звідси, концентрацію бору в отриманому розчині розраховують за формулою:
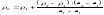
де ρх , ρ1 , ρ2 - масові концентрації аналізованого і стандартних розчинів нижчої і вищої
концентрації;
Ix, I1, І2 - інтенсивностi люмінесценції аналізованого і стандартного розчинів.
Підставляючи числові значення, одержуємо
 ,
мкг/мл
,
мкг/мл
Масу бора в харчовому продукті знаходимо за формулою:

Підставляючи числові значення, одержуємо: