
- •Обмен аминокислот. Дезаминирование и трансаминирование аминокислот. Обезвреживание аммиака. Образование и выведение мочевины.
- •Основные вопросы лекции:
- •Белки – высокомолекулярные органические полимеры, построенные из аминокислот, связанных между собой
- •Ежесуточно в организме человека обновляется 1 - 2% всех белков (300 г/сут)
- •Обновление белков организма
- •Пул (фонд) свободных аминокислот
- •Азотистый баланс
- •Факторы, влияющие на интенсивность азотистого обмена
- •Поступление белков с пищей
- •Качественный состав белка зависит от состава аминокислот.
- •Биологическая ценность белка определяется его аминокислотным составом.
- •Недостаточность белка в рационе. Квашиоркор -
- •Недостаточность аминокислот.
- •Протеолиз – распад белков до аминокислот.
- •Переваривание белков в ЖКТ
- •Образование и функции соляной кислоты
- •Изменения концентрации Hcl в желудочном соке
- •Ферменты желудочного сока
- •Ферменты желудочного сока.
- •Переваривание белков в тонком кишечнике осуществляется ферментами панкреатического происхождения.
- •Активация трипсина.
- •Ферменты кишечного сока синтезируются клетками тонкого
- •Защита клеток ЖКТ от действия протеаз.
- •Транспорт аминокислот в клетки.
- •Нарушение переваривания белков и транспорта аминокислот.
- •Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения.
- •Применение протеолитических ферментов и их ингибиторов.
- •Катаболизм аминокислот.
- •Общие пути катаболизма аминокислот.
- •Дезаминирование аминокислот. Поток азота в ходе катаболизма аминокислот.
- •Катаболизм аминокислот начинается с удаления аминогруппы.
- •Анаэробное прямое окислительное дезаминирование
- •Непрямое дезаминирование. Дезаминирование через стадию трансаминирования -
- •Химизм процесса трансаминирования
- •В наиболее значимых реакциях трансаминирования участвуют аспартатаминотрансфераза (АСТ)
- •Клинико-диагностическое значение определения активности аминотрансфераз крови.
- •Локализация аминотрансфераз в клетке
- •Изменение активности АЛТ, АСТ в крови при заболеваниях печени и миокарда.
- •Аминокислоты могут давать энергию. Гликогенные и кетогенные аминокислоты.
- •Глюкозо - аланиновый цикл
- •В клетках постоянно образуется аммиак.
- •Пути обезвреживание аммиака в организме.
- •Токсичность аммиака.
- •Восстановительное аминирование α-кетоглутарата с образованием глутаминовой кислоты..
- •Синтез глутамина - одним из важных способов утилизации аммиака в нервной и мышечной
- •С током крови ГЛУ (н) транспортируется в почки, где происходит гидролиз ГЛУ(н) под
- •Печень – единственный орган, клетки которого содержат все ферменты биосинтеза мочевины.
- •Синтез карбамоилфосфата – ключевая реакция синтеза мочевины.
- •Цитруллин – аминокислота, которая не кодируется генетически
- •Аспартат – источник NH2–группы.
- •Аргинин синтезируется при распаде аргининосукцината.
- •Орнитин – аминокислота, которая не кодируется генетически.
- •Синтез мочевины – регулируемый процесс.
- •Гипераммониемия
- •Энзимопатии орнитинового цикла.
- •Определение концентрации мочевины
- •Определение концентрации мочевины
- •Определение концентрации мочевины в биологических жидкостях при
- •Определение концентрации мочевины в биологических жидкостях.
- •Благодарю за внимание!
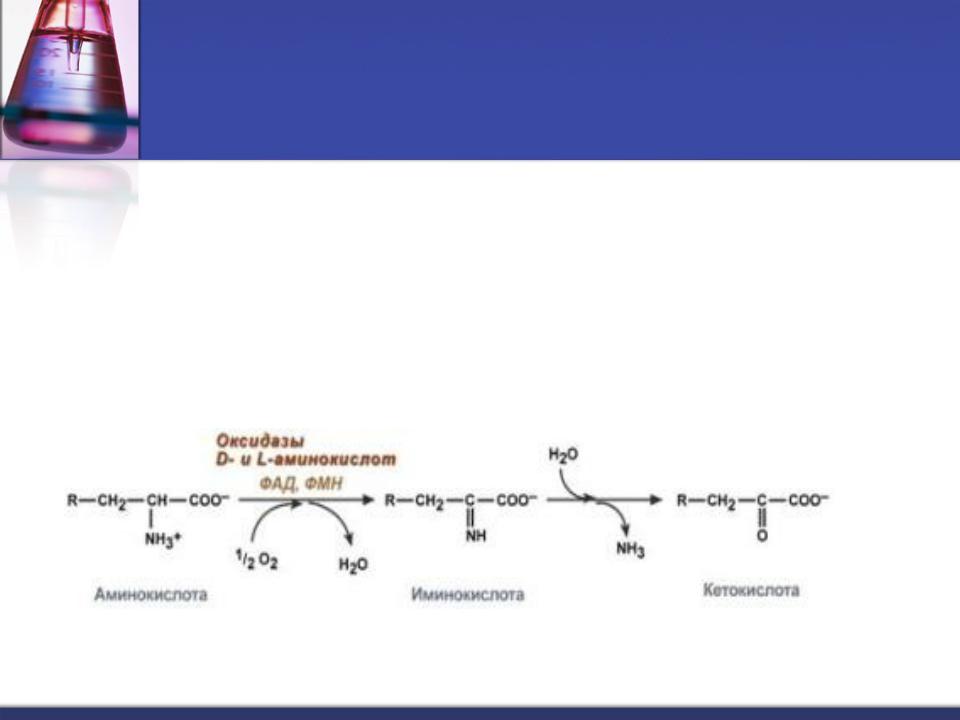
Катаболизм аминокислот начинается с удаления аминогруппы.
Основным механизмом является окислительное дезаминирование. Выделяют 2 варианта: прямое и непрямое.
Аэробное прямое окислительное дезаминирование
катализируется оксидазами D-аминокислот (кофермент ФАД),
иоксидазами L-аминокислот (коферментом ФМН).
В организме человека эти ферменты присутствуют, но малоактивны.
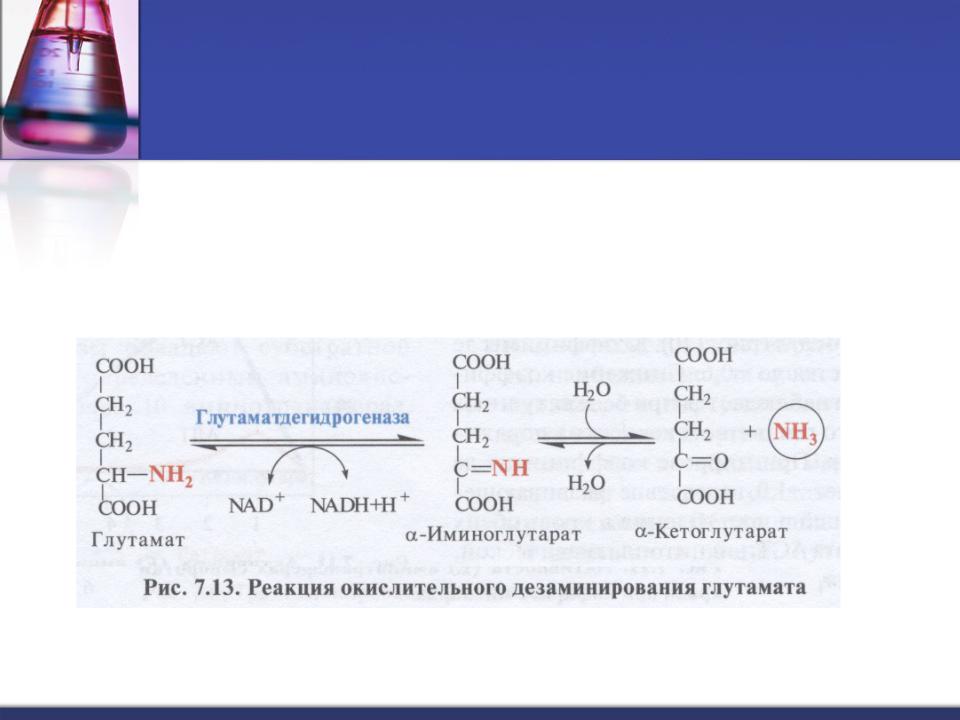
Анаэробное прямое окислительное дезаминирование
возможно только для ГЛУ,
катализируется глутаматдегидрогеназой.
Фермент имеется в митохондриях всех клеток (кроме мышц!)
Этот тип дезаминирования связан с трансаминированием.
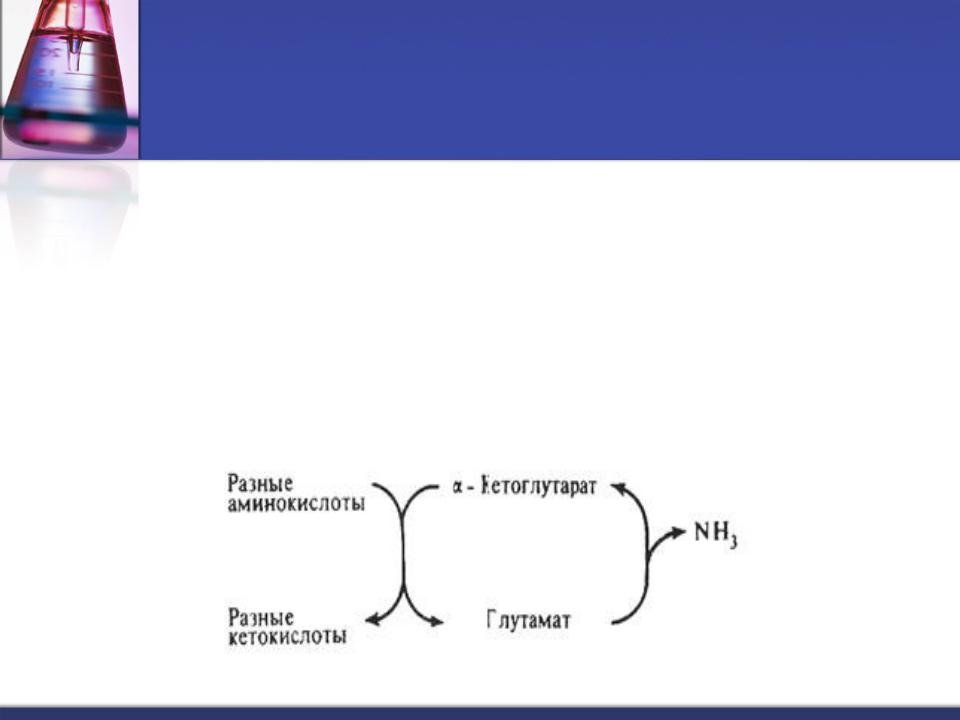
Непрямое дезаминирование. Дезаминирование через стадию трансаминирования -
это реакции переноса α- NH2 с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая
аминокислота. Процесс обратим.
Реакции катализируют ферменты аминотрансферазы,
кофермент - пиридоксальфосфат (ПФ) - производное витамина В6.
Аминотрансферазы обнаружены в цитоплазме и митохондриях клеток печени, мышц, мозга и др.
В клетках человека обнаружено > 10 аминотрансфераз

Химизм процесса трансаминирования
Процесс идет через образование промежуточных соединений |
(шиффовых оснований) без высвобождения NH3. |
|
|
|
|
1-я стадия непрямого окислительного дезаминирования. |
|
|
|
в ЦТК (образование ЩУК, α-кетоглутарата). |
|
Углеродный остаток аминокислот может включаться |
|
|
|
|
|
Возможен синтез 10 заменимых аминокислот. |
|
|
|
разработали советские биохимики во главе |
с академиком А.Е. Браунштейном |
Общую теорию механизма трансаминирования |
||
|
|
|
(1937). |
|
|

В наиболее значимых реакциях трансаминирования участвуют аспартатаминотрансфераза (АСТ)
и аланинаминотрансфераза (АЛТ)

Клинико-диагностическое значение определения активности аминотрансфераз крови.
В крови определяют активность аланинаминотрансферазы (АлАТ, АЛТ), аспартатаминотрансферазы (АсАТ, АСТ)
-с целью диагностики заболеваний,
-с целью прогноза течения заболевания,
-с целью контроля за эффективностью лечения.
Внорме активность ферментов в крови очень низкая!
АЛТ 0,1–0,68 мкмоль/мл/час АСТ 0 - 0,45 мкмоль/мл/час Коэффициент де Ритиса АСТ/АЛТ = 1,33 (норма)

Локализация аминотрансфераз в клетке
Цитоплазма: АЛТ > АСТ Митохондрии: АСТ > АЛТ
Причины повышения активности аминотрансфераз в крови:
↑ АЛТ свидетельствует о нарушении проницаемости клеточной мембраны
(активация
ПОЛ, незначительные повреждения клеток, воспаление).
↑ АСТ свидетельствует о нарушении целостности клеточных органелл, цитолизе.
(гибель клеток, некроз
тканей).
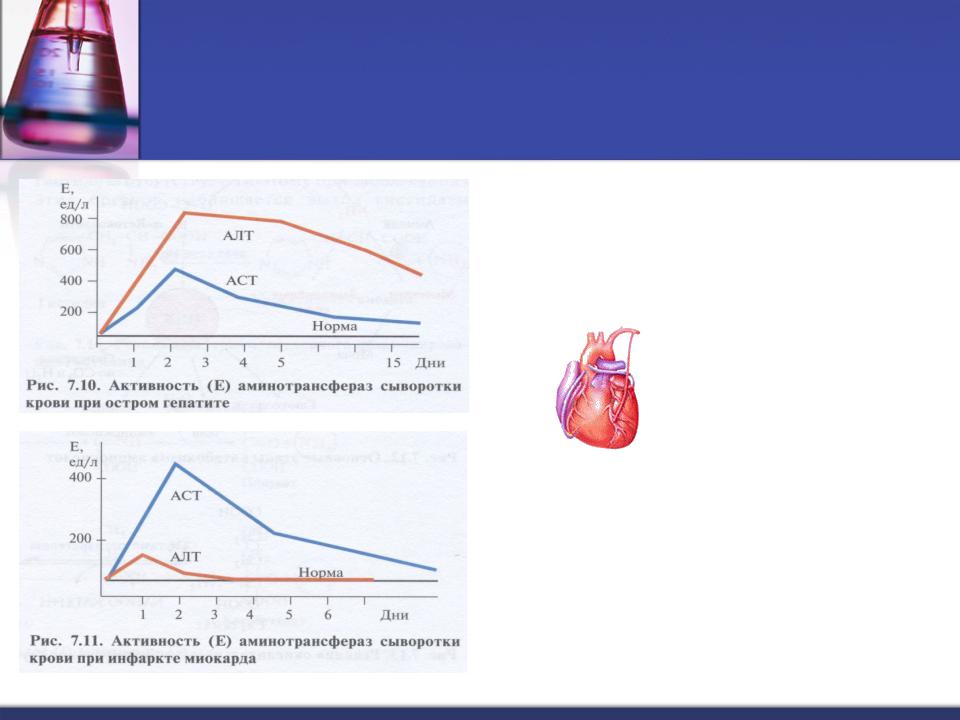
Изменение активности АЛТ, АСТ в крови при заболеваниях печени и миокарда.
Гепатит:
Активность АЛТ > АСТ
Коэффициент де Ритиса < 1,33
Инфаркт миокарда:
Активность АСТ > АЛТ Активность АСТ резко повышается
(в 20-30 раз) через 3 - 5 часов после болевого приступа.
Коэффициент де Ритиса > 1,33
(Биохимия с упражнениями и задачами: Учебник/Под ред. Е.С.Северина.- М.: «ГЭОТАР», 2008 – 384 с.
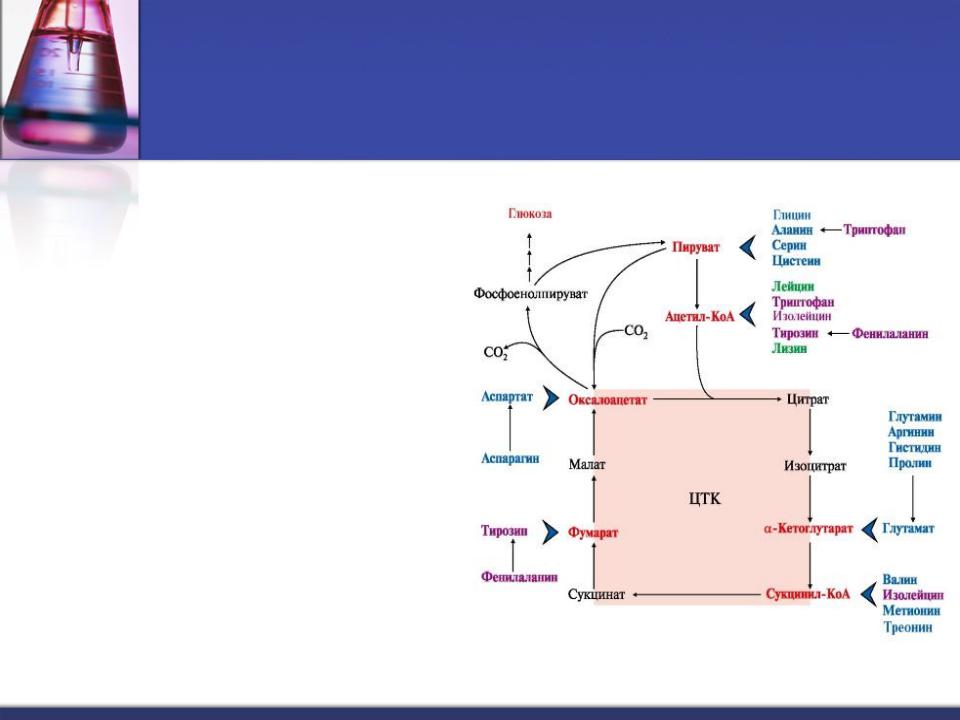
Аминокислоты могут давать энергию. Гликогенные и кетогенные аминокислоты.
Из общего количества АТФ, образующейся в организме, на катаболизм аминокислот приходится ~ 10%.
Аминокислоты, которые превращаются ПВК и кислоты ЦТК, могут использоваться в процессе глюконеогенеза-
гликогенные аминокислоты.
Некоторые аминокислоты процессе катаболизма превращаются
в ацетоацетат |
(Лиз, Лей) |
или ацетил-КоА (Лей) |
и |
могут использоваться в синтезе кетоновых тел -
кетогенные аминокислоты.
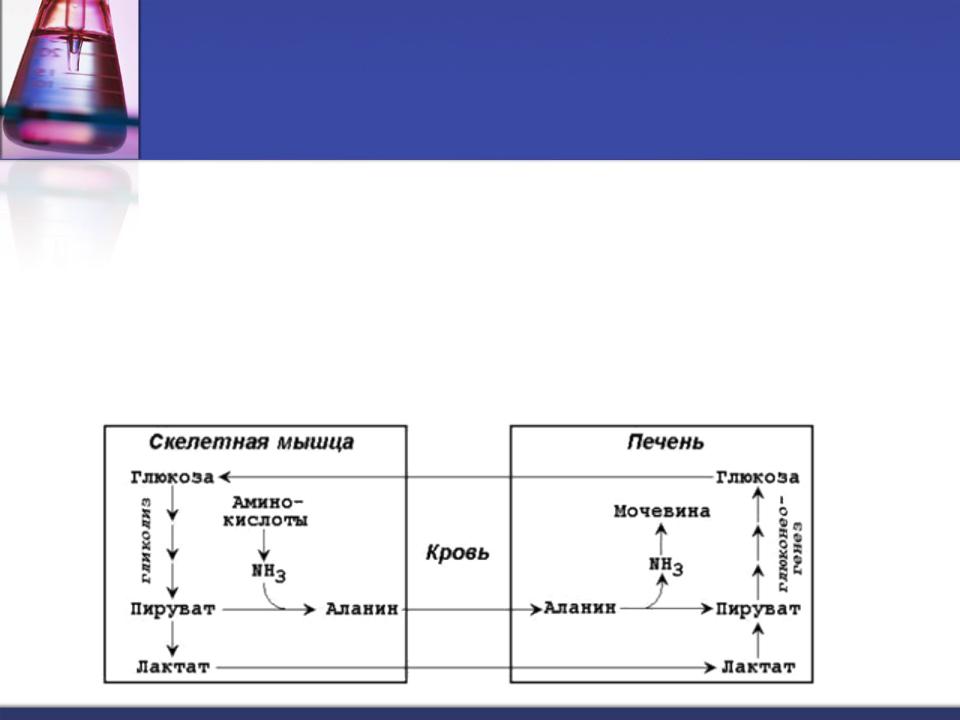
Глюкозо - аланиновый цикл
Ведущее место в глюконеогенезе принадлежит аланину, который превращается в пируват путём трансаминирования.
При голодании и физической работе в организме функционирует
глюкозо – аланиновый цикл
|
(подобен циклу Кори для лактата). |
|
|
Работа цикла препятствует отравлению организма, так как в мышцах |
нет |
|
ферментов, утилизирующих аммиак. |
|
|
При тренировке мощность цикла значительно возрастает. |
|
