
- •2 Вопрос Сравнение способов нанесения металлопокрытий из водных растворов.
- •6 Вопрос Основные компоненты растворов химической металлизации.
- •8 Вопрос Технологические параметры процессов химической металлизации.
- •9 Вопрос Причины нестабильности растворов химической металлизации.
- •10 Вопрос Трактовки процесса химической металлизации.
- •12 Вопрос Варианты сопряжения реакций при химической металлизации.
- •13 Вопрос Современные представления о механизме процесса химической металлизации.
- •14 Вопрос Причины каталитической активности металлических основ.
- •16 Вопрос Модификация поверхности металлических основ в условиях придания ей каталитичности.
- •18 Вопрос Поведение пассивных основ в растворах химической металлизации.
- •19 Вопрос Особенности подготовки поверхности.
- •21 Вопрос Химическое меднение.
- •24 Вопрос Тартратные растворы химического меднения.
- •22 Вопрос Механизм химического меднения.
- •23 Вопрос Требования к лигандам при меднении.
- •25 ВопросПроблемы стабилизации растворов химического меднения.
- •26 Вопрос Причины нестабильности.
- •28 Вопрос Механизм процесса химического никелирования.
- •29 Вопрос Структура и свойства покрытия Nipa.
- •33 Вопрос Химическое золочение.
- •38 Вопрос Оборудование для процессов химической металлизации.
9 Вопрос Причины нестабильности растворов химической металлизации.
Малая стабильность
раствора является одним из недостатков
технологии химической металлизации.
Это связано с тем, что изначально растворы
химической металлизации являются
термодинамически неустойчивыми из-за
большой разницы потенциалов металла и
восстановителя. Т.е. процесс идёт
самопроизвольно, и часто начинается
непосредственно в объёме раствора.
Процесс разложения развивается во
времени и включает в себя стадию
гомогенной реакции, непосредственного
взаимодействия ионов металла и
восстановителя с образованием частички
металла, стадию роста этого кристаллика
до определённых размеров и стадию
превращения этого кристаллика
непосредственно в каталитическую
поверхность, когда реакция восстановления
становится гетерогенной. Стабильной
раствора металлизации зависит от
линейного размера этих кристаллов, и
выражается через величину критического
радиуса
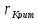 .
Когда процесс идёт по гомогенному
механизму, критический радиус ещё не
достигается и раствор остаётся стабильным.
Именно в этот момент должны действовать
добавки стабилизаторов, адсорбируясь
на таких частицах и их блокируя. Если
стабилизаторов нет, радиус частиц
превышает критические размеры и реакция
идёт как каталитическая. Здесь линейные
размеры сильно увеличиваются, что
приводит к образованию порошкообразного
осадка непосредственно в объёме. Раствор
разлагается, причём в этом случае в
объёме может выделиться весь металл из
соли.
.
Когда процесс идёт по гомогенному
механизму, критический радиус ещё не
достигается и раствор остаётся стабильным.
Именно в этот момент должны действовать
добавки стабилизаторов, адсорбируясь
на таких частицах и их блокируя. Если
стабилизаторов нет, радиус частиц
превышает критические размеры и реакция
идёт как каталитическая. Здесь линейные
размеры сильно увеличиваются, что
приводит к образованию порошкообразного
осадка непосредственно в объёме. Раствор
разлагается, причём в этом случае в
объёме может выделиться весь металл из
соли.
Схема разложения раствора может быть следующей:
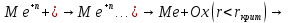
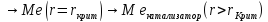
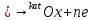
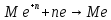
И процесс идёт не на детали, а в объёме!
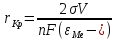
Сигма – поверхностное натяжение на границе частица металла/раствор, V – мольный объём металла, внизу – разность потенциалов между восстановителем и металлом. Чем больше разность, тем меньше критический радиус, тем быстрее объёмная частица становится катализатором и тем быстрее разлагается раствор. Например, разность потенциалов серебро/гидразин больше, чем никель/гипофосфит, а значит, растворы химсеребрения будут менее стабильны, чем растворы химникелирования. Даже при химическом никелировании получаются различные критические радиусы в зависимости от вида восстановителя.
Ni-ГБ, разность 0,3 В, радиус 0,6 нм; Ni-ГФ, разность 0,2 В, критический радиус 0,8; Ni-БГ – радиус 0,15 и радиус 1,1.
Чем более положительный потенциал у металла, тем менее стабильным может быть раствор. Чем отрицательнее металл, тем раствор получается более стабильным, причём на величину потенциала металла будут влиять лиганды, температура и добавки, например – окислители. В этом случае разность потенциалов может быть снижена и раствор можно стабилизировать более легко.
Существенно снизить величину критического радиуса могут различные объёмные загрязнения, труднорастворимые соли, твёрдые частицы, различные неровности и шероховатости на поверхности реактора, частицы пыли или грязи. Все эти участки способствуют адсорбции восстановителя и ионов металла для начала гомогенной реакции, которая затем быстро перейдёт в гетерогенную. Вывод – растворы химической металлизации должны готовиться из наиболее чистых химикатов, и надёжно фильтроваться от разнообразных твёрдых частиц.
Факторы, снижающие стабильность раствора:
-
Концентрация ионов металла и восстановителя.
Избыточные концентрации увеличивают разность потенциалов и снижают критический радиус. То же относится к температуре. Чем выше температура, тем отрицательнее становится потенциал восстановителя и снижается критический радиус.
-
Комплексы и их прочность.
Прочные комплексы не дают возможности образованию твёрдых частиц гидроксидов, что стабилизируют раствор. Комплексы также тормозят взаимодействие труднорастворимых солей металла с продуктами окисления восстановителя. Ряд комплексов в ходе высокотемпературных процессов быстро разрушаются, и это нужно учитывать в плане стабильности.
-
Избыточные плотности загрузки.
Приводят к тому, что процесс с полезного перераспределяется на побочные реакции. В результате быстрее изменяется pH, отрываются частички металлопокрытия, переходя в объём раствора, быстрее нарабатываются продукты реакции с образованием труднорастворимых солей. Плотность загрузки нужно держать в определённых пределах.
-
Для повышения стабильности нужна периодическая или непрерывная фильтрация раствора.
-
Для повышения стабильности необходимо вводить добавки стабилизаторов, которые избирательно действуют на мелкие объёмные частицы докритического радиуса, блокируя их.
Добавки стабилизаторов можно проверить по следующему параметру.
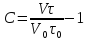
V – скорость процесса, тау – время до разложения раствора, наверху – при наличии добавки, внизу – без добавки. Если C<0, то добавка ухудшает процесс; C=0 – добавка не действует; C>0 – добавка используется как стабилизатор.
Лекция 3. 18/11/15
