
- •2 Вопрос Сравнение способов нанесения металлопокрытий из водных растворов.
- •6 Вопрос Основные компоненты растворов химической металлизации.
- •8 Вопрос Технологические параметры процессов химической металлизации.
- •9 Вопрос Причины нестабильности растворов химической металлизации.
- •10 Вопрос Трактовки процесса химической металлизации.
- •12 Вопрос Варианты сопряжения реакций при химической металлизации.
- •13 Вопрос Современные представления о механизме процесса химической металлизации.
- •14 Вопрос Причины каталитической активности металлических основ.
- •16 Вопрос Модификация поверхности металлических основ в условиях придания ей каталитичности.
- •18 Вопрос Поведение пассивных основ в растворах химической металлизации.
- •19 Вопрос Особенности подготовки поверхности.
- •21 Вопрос Химическое меднение.
- •24 Вопрос Тартратные растворы химического меднения.
- •22 Вопрос Механизм химического меднения.
- •23 Вопрос Требования к лигандам при меднении.
- •25 ВопросПроблемы стабилизации растворов химического меднения.
- •26 Вопрос Причины нестабильности.
- •28 Вопрос Механизм процесса химического никелирования.
- •29 Вопрос Структура и свойства покрытия Nipa.
- •33 Вопрос Химическое золочение.
- •38 Вопрос Оборудование для процессов химической металлизации.
Литература:
-
Гальванотехника (под ред. А.М. Гинберг), 87 г.
-
Шалкаускас М. В., Вашкялис А., «Химическая металлизация пластмасс», И: Куча, 69-92 г. Чем старее – тем подробнее, чем новее – тем больше практики.
-
Вишенков С.А., «Химические и электротермохимические способы осаждения металлопокрытий».
-
Флеров В.Н., «Химические технологии в производстве радиоэлектронных деталей»
-
Свиридов, «Химическое осаждение металлопокрытий»: растворы, элементы теории
-
Задачник Флерова – всякая расчётная часть, реакторы металлизации
Лекция 1. 04/11/15 1 вопрос
Химическая металлизация – это способ нанесения металлопокрытий без применения электрического тока. Процесс ведётся из водных растворов за счёт протекания на поверхности деталей определённых химических реакций. Это – относительно новое, развивающееся направление процессов металлизации.
Химическим способом наносят достаточно много металлов: Cu, Ni, Co, Fe, Pd, Au, Ag, Pt, Ro, Rt и их сплавы. Элементы химической металлизации известны ~200 лет, например – получение медных зеркал, когда на поверхность стекла химическим способом наносится слой меди; реакция серебряного зеркала, когда под действием восстановителя серебро из ионного состояния восстанавливается на стенках реактора до металла в виде зеркала.
Бурный рост процессов химической металлизации начался в середине прошлого века, когда, уже в промышленном масштабе, на разнообразные металлические и не металлические детали стали наносить относительно толстые покрытия с нужными функциональными свойствами. Такие технологии за рубежом получили торговое название «Kanigen» (NiF) и «Nibogur» (Ni-B).
Развитие процессов химической металлизации произошло из-за того, что в данной технологии можно получить достаточно толстое, максимально равномерное по толщине покрытие на сложном профиле детали. При этом источники тока не требуются, аноды и электрические контакты не нужны, можно проводить металлизацию различных основ, как металлических, так и диэлектрических, включая стекло, пластмассы, ткани, порошки, волокна и тому подобное. Также можно металлизировать такие детали, к участкам которых электрический контакт подвести или очень сложно, или невозможно вообще: на некоторых печатных платах количество участков под металлизацию может достигать нескольких сотен. Понятно, что электрический контакт к этим разрозненным участкам подвести затруднительно или невозможно.
Процесс химической металлизации расширился с развитием электронной техники, где детали очень миниатюрны, со множеством контактных площадок. На таких деталях часто используются покрытия из драгоценных металлов для обеспечения проведения сборочных операций (пайка, сварка). Кроме того, в случае благородных металлов, за счёт максимальной равномерности толщины, можно экономить драгоценные металлы при металлизации сложных по профилю деталей. Затраты золота на технические нужды исчисляются сотнями тонн в год, поэтому, применяя химические методы осаждения благородных металлов, можно существенно снизить затраты золота или других металлов. Кроме того, при химическом осаждении металлопокрытий можно получить различные сплавы, многокомпонентные, включающие в себя как несколько металлов, так и сплавы металла с неметаллом. Неметалл включается в покрытие благодаря протеканию химических реакций непосредственно в процессе восстановления.
Такие сплавы трудно получить металлургическим путём (или вообще невозможно), и такие сплавы обладают рядом ценных характеристик: хорошей коррозионной стойкостью, высокой твёрдостью и износостойкостью, термостойкостью, способностью к пайке и сварке, относительно низким и стабильным электрическим сопротивлением. В ряде случаев, такие сплавы могут на некоторых изделиях заменять покрытия (гальванические) из драгоценных металлов, что даёт дополнительную экономию. Функциональными свойствами таких сплавов можно управлять, можно получать покрытия с необходимыми свойствами.
Недостатки: как правило, процессы химической металлизации – высокотемпературные, t > 90 C. Скорости процессов металлизации – меньше, чем в гальванике, и эти скорости уменьшаются во времени по мере выработки компонентов раствора в ходе протекания процесса. Растворы – не вечные, и продукты реакции, накапливаясь, делают раствор не работоспособным. Получаются большие объёмы отработанных растворов, которые нужно направлять на утилизацию. Высокотемпературные процессы выставляют определённые требования к подбору материала реактора. Материал должен быть термостойким, и в то же время – не быть каталитически активным самому процессу химической металлизации, иначе весь процесс пойдёт не на детали, а на стенках реактора.
Исходя из этого, обычные металлические реакторы нельзя применять. Чаще используют реакторы из стекла, фарфора, фторопласта и некоторых термостойких пластмасс. Если рассматривать технологию электроосаждения и химического осаждения металлов, то, несмотря на определённую конкуренцию между ними, каждый из этих процессов дополняет другой, и в зависимости от вида детали, материала, конфигурации и свойств покрытия всегда можно подобрать оптимальную технологию нанесения металлопокрытия.
2 Вопрос Сравнение способов нанесения металлопокрытий из водных растворов.
-
Контактный обмен.
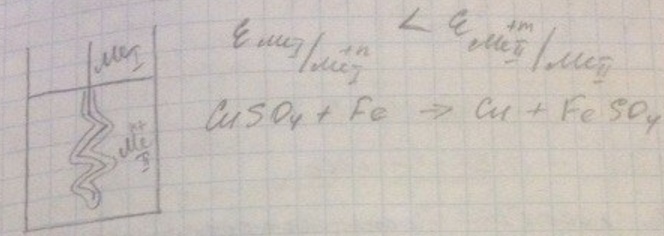
Берётся ячейка, туда погружается деталь. Если потенциал металла-1 более отрицателен, чем потенциал металла-2, то происходит контактный обмен и на поверхности детали осаждается слой металлопокрытия.
Контактная медь, контактное золото и так далее. Процесс кончается тогда, когда потенциалы выравниваются, т.е. поверхность основы зарастает слоем металлопокрытия. Поэтому толстые покрытия получить нельзя, а т.к. основа подрастворяется, прочность сцепления покрытия с основой плохая. Такая технология практически не применятся для ответственных деталей.
-
Гальванический способ
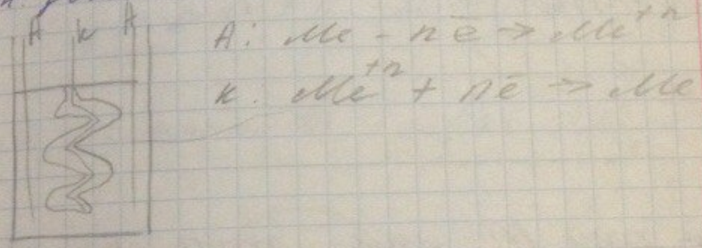
Требуются источники тока, аноды. Неравномерное покрытие – неудобно и не выгодно. Возникают затраты электроэнергии, электролиты часто вредные. На аноде растворяется металл, на катоде он садится.
-
Химическая металлизация
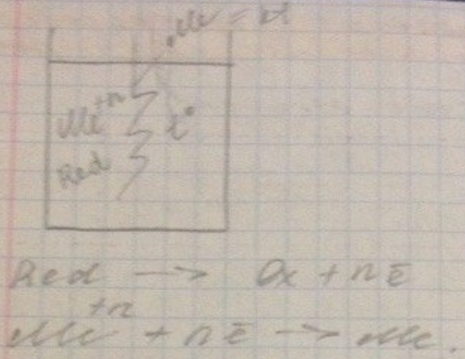
Отличительной особенностью является наличие в растворе обязательного компонента – восстановителя, который является донором электронов и поставляет их ионам металла покрытия, которые высаживаются на поверхности детали. Металл детали должен обладать каталитическими свойствами к реакции окисления восстановителя.
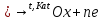
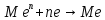
Слой получается равномерным на любом сложном профиле. Не все металлические основы первоначально являются катализаторами, и часто их принудительно нужно делать каталитически активными. С другой стороны, если металл стал катализатором или был им, то процесс окисления восстановителя пойдёт самопроизвольно, а т.к. само металлопокрытие является катализатором, значит, восстановитель будет окисляться на нём, давая электроны, благодаря чему процесс самовозобновляется и может идти достаточно долго, особенно в условиях корректировки раствора по расходуемым компонентам. Можно получать достаточно толстые и равномерные покрытия.
Каталитически активных основ не столь много, например: для химического никелирования – это железо, никель, кобальт, палладий, рений; все другие металлические основы (медь, свинец, латунь, алюминий) надо делать каталитически активными, применяя способы различной предварительной подготовки.
Основные восстановители, применяемые в процессах химической металлизации.
|
Формула |
Название |
Обозначение |
Рабочая температура, С |
Равновесный потенциал |
pH |
Скорость металлизации, мкм/ч |
|
NaH2PO2 |
Гипофосфит натрия |
ГФ |
90-98 (иногда 40-60) |
-1,57 |
4-5 или 8-9 |
20-25 |
|
NaBH4 |
Боргидрид натрия |
БГ |
90-98 |
-1,24 |
13-14 |
20-25 |
|
(CH3)2HN*BH3 |
Диметиламиноборан |
ДМАБ |
50-80 |
-1,15 |
4-10 |
7-9 |
|
N2H7*H2O |
Гидразингидрат |
ГГ |
85-95 |
-1,11 |
8-10 |
4-12 |
|
N2H4*BH3= |
Гидразинборан |
ГБ |
20-25 |
Хз |
8-10 |
0,5-1,5 |
|
CH2O |
Формалин |
Ф |
18-25 |
-1,09 |
11-13 |
0,5-1,5 |
Боргидрид натрия разлагается при pH<13.
Диметилборан годится для металлизации не термостойких материалов, лёгких металлов и сплавов, которые не корродируют в нейтральной среде.
Гидразинборан рекомендовали для нанесения первого, тонкого слоя металла на поверхность диэлектрика, а затем уже по такому слою, за счёт технологий электроосаждения, наращивали толстые слои необходимых металлопокрытий, например – меди.
Силу восстановителя можно восстановить исходя из его равновесного потенциала. Чем более отрицательный потенциал, тем сильнее должен быть восстановитель. Здесь более важно соотношение между потенциалом восстановителя и потенциалом осаждаемого металла. Движущая сила процесса будет тем больше, чем более положительным будет потенциал металлопокрытия. Но потенциал металлопокрытия будет зависеть от состава электролита, наличия лигандов, pH раствора, концентрации, температуры. На движущую силу мы сможем влиять.
Важно, сколько электронов может поставлять восстановитель в ходе своего окисления. Количество электронов будет зависеть от механизма процесса, который будет реализовываться в конкретных условиях, и не всегда реализуются максимальные условия поставки электронов в ходе окисления восстановителя. Например, максимальное количество электронов для боргидрида – 8, для аминоборанов – 6, для гидразинов – 4, для гипофосфита – 2. В реальности, количество поставляемых электронов в два раза меньше.
Важное свойство восстановителей – возможность получения с их помощью сплавов, включающих металл и не металл, которые обладают важными функциональными свойствами.
Вид сплава металла с неметаллом будет зависеть от вида восстановителя и вида ионов металлопокрытия.
|
|
ГФ |
БГ |
ДМАБ |
Ф |
ГГ |
|
Ni2+ |
Ni-P |
Ni-B |
Ni-B |
- |
Ni |
|
Co2+ |
Co-P |
Co-B |
Co-B |
- |
- |
|
Fe2+ |
Fe-P |
Fe-B |
Fe-B |
- |
- |
|
Pd2+ |
Pd-P |
- |
Pd-B |
- |
Pd |
|
Cu2+ |
Cu |
Cu-B |
Cu-B |
Cu |
- |
|
Au+ |
Au |
Au |
Au |
- |
- |
Подбирая восстановитель и нужные ионы металла, можно получать как двухкомпонентные сплавы, так и многокомпонентные. Например, Ni-Co-F или Ni-Fe-B. В практике, наиболее широко применяются химические покрытия из меди, никеля, золота и, реже, серебра. Химическое меднение широко применяется в производстве печатных плат, для металлизации внутренних поверхностей отверстий, которые соединяют слои платы между собой. В результате формирования таких отверстий методом сверления связь между частями платы нарушается, и внутренняя поверхность отверстий достаточно малого размера должна быть токопроводящей. Процесс химического меднения позволяет, после специальной подготовки, нанести металл и соединить внутренние слои платы между собой.
Другое направление химического меднения – создание первого электропроводящего слоя на поверхности пластмасс под декоративную отделку. После специальной подготовки, на поверхность диэлектрика наносится тонкий слой химической меди (не более 1,5 мкм), который делает поверхность диэлектрика электропроводной, а значит, по этому слою можно дополнительно наращивать гальванически другие слои металла, вплоть до получения многослойных покрытий. Например, слой гальванической меди, слой никеля и верхний слой хрома. Такая технология используется для декоративной отделки деталей приборов или деталей автомобилей. Используется дешёвый и доступный формалин.
Наиболее широкое применение имеет процесс химического никелирования. Он позволяет получать фосфор- или борсодержащие никелевые покрытия, которые обладают высокой коррозионной стойкостью, очень высокой твёрдостью и износостойкостью, термостойкостью на воздухе, а также теми свойствами, которые нужны для изделий электронной техники и приборостроения, для проведения сборочных операций. Размеры детали могут быть различными, от турбин ГЭС и до деталей часовой техники.
Достаточно широко применяются процессы химического золочения. Этот процесс реализуется в электронной технике для замены традиционного гальванического золочения. Цель – экономия драгоценных металлов. Такая экономия достигается за счёт повышения равномерности толщины и за счёт того, что не нужны аноды из драгоценных металлов и не нужны токоподводы, куда неизбежно будет осаждаться золото.
Процесс химического золочения особенно выгоден на различных микроизделиях, где существуют различные, не связанные между собой в единую цепь, участки, подлежащие металлизации. При химическом золочении толщину покрытий можно менять, используя те или иные растворы. Первоначально, толщина золотого покрытия должна была быть порядка 3-3,5 мкм, и, в случае использования электроосаждения, толщина получалась примерно в 2 раза больше, идёт перерасход. В последнее время применяется тонкослойное золотое покрытие, где для проведения сборочных операций достаточно толщины в 1,5 мкм и менее. В этом случае процесс химического золочения ещё более выгоден, т.к. такие скорости металлизации реализуются практически во всех растворах химического золочения.
Покрытия из других благородных металлов используются реже; серебряные покрытия используют в различных электрических контактах, такие покрытия, за счёт атмосферных воздействий, ухудшают свои электрические характеристики. Для ответственных деталей и различных контактов можно использовать покрытия из палладия, так как он является более твёрдым по сравнению с серебром и золотом и контакты могут служить более длительное время.
Во времена роста экономики, использование химически осаждённых покрытий в год увеличивалось на 15-50%.
Лекция 2. 11/11/15
