
Диаграммы плав
.pdf
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Новгородский государственный университет им. Ярослава Мудрого
Факультет естественных наук и природных ресурсов Кафедра химии и экологии
ДИАГРАММЫ ПЛАВКОСТИ ДВУХКОМПОНЕНТНЫХ СИСТЕМ
Методические указания к лабораторной работе
Великий Новгород
2006 г
2
Диаграммы плавкости двухкомпонентных систем: Методические указания/Сост. В.П. Кузьмичева. – Великий Новгород: НовГУ, 2006. – 15 с.
3
СОДЕРЖАНИЕ
1 |
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ................................................ |
4 |
|
1.1 |
Основы физико-химического анализа................................................................. |
4 |
|
1.2 |
Термический анализ, кривые охлаждения.......................................................... |
5 |
|
1.3 |
Диаграмма плавкости с образованием эвтектической смеси........................... |
7 |
|
1.4 |
Диаграмма плавкости с образованием химического (интерметаллического) |
||
соединения................................................................................................................... |
9 |
||
1.5 |
Диаграмма плавкости с образованием непрерывных твёрдых растворов.... |
11 |
|
1.6 |
Диаграмма плавкости для металлов, образующих твёрдые растворы |
|
|
ограниченной растворимости................................................................................... |
12 |
||
2 |
ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ .................................................. |
13 |
|
3 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ...................................................................... |
14 |
|
3.1 |
Снятие и построение кривых охлаждения........................................................ |
14 |
|
3. 2 Построение диаграммы плавкости................................................................... |
15 |
||
4 |
ТРЕБОВАНИЯ К ОТЧЁТУ................................................................................... |
15 |
|
5 |
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ .......................................................... |
15 |
|
ЛИТЕРАТУРА........................................................................................................... |
15 |
||
4
1 ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
1.1 Основы физико-химического анализа
Одним из общих свойств металлов является способность их образовывать сплавы между собой.
Металлическими сплавами называются продукты физико-химического взаимодействия металлов (компонентов) между собой, в которых сохраняется металлический тип связи. Для облегчения этого взаимодействия обычно смесь компонентов переводится нагреванием в жидкое состояние, а затем в результате охлаждения она кристаллизуется, образуя сплав. Свойства сплавов определяются составом, температурой и природой физико-химического взаимодействия.
Если взять два металла А и В и их расплавить, то при последующей кристаллизации их расплава можно наблюдать три случая взаимодействия:
А + В исходная смесь (расплав)
|
|
|
кристаллизация |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
механическая смесь |
|
твёрдые |
|
химические |
|||
кристаллов А + В |
|
растворы |
|
(интерметалличес- |
|||
|
|
|
|
|
|
кие) соединения |
|
|
|
|
|
|
|
|
|
Для установления природы, или характера химического взаимодействия был разработан метод физико-химического анализа, основанный академиком Н. С. Курнаковым (1860 – 1941).
С помощью метода физико-химического анализа устанавливают зависимость между изучаемым физическим свойством и составом сплава и выражают результаты исследования в виде диаграммы свойство – состав. Для этого на оси абсцисс откладывается состав сплавов, на оси ординат – изучаемое физическое свойство. Точки свойств соединяются между собой и получается графическая зависимость изменения данного свойства от состава.
Анализ диаграммы свойство – состав позволяет определить число и химическую природу фаз, границы их существования, характер взаимодействия компонентов, наличие соединений, их состав и относительную устойчивость, т. е. можно составить ясное представление о природе образующегося в данной системе металлического сплава.
Если компоненты А и В взаиморастворимы друг в друге и образуют непрерывный ряд твёрдых растворов после кристаллизации, свойства изменяются по плавным кривым (рис. 4а), вогнутым или выпуклым к оси состава. Если образуется механическая смесь, то изменения свойств происходят

5
по кривой, возрастая или убывая при добавлении одного компонента к другому (рис. 2). Если образуется химическое соединение (интерметаллическое), то на кривых изменения свойств от состава имеется особая точка максимума (c) на ординате химического соединения (рис. 3а).
На основании полученных результатов Н. С. Курнаковым были установлены два принципа – непрерывности и соответствия, которые лежат в основе физико-химического анализа.
Принцип непрерывности гласит, что при непрерывном изменении параметров (концентрация, давление, температура), определяющих состояние системы, непрерывно изменяются и свойства фаз, из которых состоит система до тех пор, пока не изменится число или характер фаз. При появлении новых или исчезновении существующих фаз свойства системы изменяются скачком.
Принцип соответствия утверждает, что каждой фазе или комплексу фаз отвечает на диаграмме свойство – состав определённый геометрический образ: линия, точка, плоскость.
1.2 Термический анализ, кривые охлаждения
Если в качестве свойств взять температуру плавления исходных сплавов, то можно получить диаграмму плавкости данной двухкомпонентной системы, причём её вид будет различен для каждого случая взаимодействия компонентов.
Для определения температур плавления используют обычно метод термического анализа. Он заключается в снятии кривых нагревания и охлаждения сплавов в координатах температура – время.
На рис. 1. приведены примеры таких кривых.
Рис. 1. Кривые охлаждения.
1 – чистый компонент; 2 – двухкомпонентный расплав, отличающийся по концентрации от эвтектической смеси; 3 – двухкомпонентный расплав, состав которого совпадает с составом эвтектической смеси.
6
Если охлаждать чистый расплавленный компонент (металл), то зависимость между температурой и временем выражается в виде кривой охлаждения 1. Участок aв соответствует равномерному понижению температуры расплава. Затем начинается процесс кристаллизации, характеризующийся горизонтальным участком вc. Переход из жидкого состояния в твёрдое сопровождается выделением теплоты кристаллизации и поэтому, пока вся жидкость не отвердеет, температура такой однокомпонентной смеси остаётся постоянной, несмотря на отвод тепла. Отвердевший компонент вновь охлаждается (участок cd).
Кривая охлаждения 2 характеризует процесс кристаллизации двухкомпонентного расплава, заканчивающийся эвтектическим превращением (одновременной кристаллизацией обоих чистых компонентов).
Понижение температуры от a до в, как и в случае чистого компонента, происходит равномерно. Затем из расплава начинают выделяться кристаллы одного из компонентов. Так как температура отвердевания раствора (двухкомпонентного расплава), ниже, чем чистого растворителя, то это произойдёт ниже точки отвердевания чистого компонента. При этом состав жидкости будет изменяться, вследствие чего температура её отвердевания непрерывно понижается. Но выделяющаяся теплота кристаллизации замедляет темп охлаждения, поэтому, начиная с точки в, крутизна линии уменьшается. Наконец наступает момент (точка с), когда жидкость (двухкомпонентный расплав) делается насыщенной относительно обоих компонентов. Тогда они начинают кристаллизоваться одновременно, при этом температура отвердевания остаётся постоянной; на кривой охлаждения 2 появляется горизонтальный участок cd. После отвердевания всей массы (точка а) охлаждение возобновляется (кривая dе).
Таким образом, кристаллизация жидкой смеси в отличие от чистого вещества растягивается на некоторый температурный интервал, который тем значительнее, чем ближе состав расплава к чистому веществу.
Последовательно увеличивая в расплаве долю второго компонента, мы дойдём до таких концентраций, когда жидкость в момент начала отвердевания будет насыщена одновременно обоими компонентами (кривая 3). При охлаждении начинает кристаллизоваться сразу смесь компонентов при постоянной температуре (в точке в), поэтому кривая охлаждения будет такая же, как и для чистого компонента. Так как эта температура ниже температуры начала кристаллизации любых других сплавов, то сплав данного состава будет самым легкоплавким. Этот сплав называется эвтектическим (от греч. «хорошо плавящийся»).
На основании кривых охлаждения строят диаграмму плавкости, перенося с них точки, отвечающие температурным остановкам или изменению скорости охлаждения, на диаграмму температура – состав. Ниже рассмотрены различные типы диаграмм плавкости двухкомпонентных систем.
7
1.3 Диаграмма плавкости с образованием эвтектической смеси
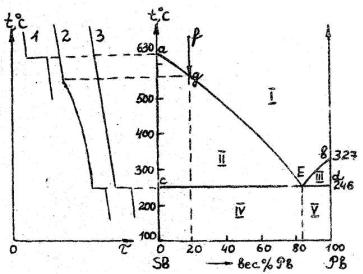
На рис. 2 показана диаграмма для системы, когда вещества неограниченно растворимы в жидком и совершенно нерастворимы в твёрдом состоянии. Подобный тип сплавов образуют металлы, резко отличные по свойствам.
Точка а отвечает температуре плавления компонента А (Sb, 630°C), точка в – температура плавления компонента В (Pb, 327°C).
Рис. 2.
Допустим, что при 650°С взята жидкая смесь, состоящая из 80% Sb и 20% Pb (точка f). При её охлаждении (кривая 2) не произойдёт никаких изменений до тех пор, пока не будет достигнута температура, соответствующая пересечению вертикали охлаждения fg с кривой аЕ (точка g). В этой точке расплав становится насыщенным сурьмой. Поэтому дальнейшее понижение температуры вызовет появление кристаллов Sb, и её концентрация в оставшейся жидкости начнёт уменьшаться. При последующем охлаждении состав жидкости изменится по кривой аЕ, пока не будет достигнута точка Е (83% Pb, 17% Sb, 246°C), в ней начнётся совместная кристаллизация оставшейся сурьмы и всего взятого свинца с образованием эвтектики – смеси мельчайших кристаллов (в данном случае кристаллов Sb и Pb). После отвердевания системы дальнейший отвод теплоты будет приводить к охлаждению твёрдого двухфазного (гетерогенного) сплава.
Если охлаждению подвергают сплав, содержащий 83 % Pb и 17 % Sb (кривая 3), то сплав образующейся твёрдой массы (точка Е) представляет собой чистую эвтектику (смесь мелких кристаллов Sb и Pb).
При других соотношениях металлов к эвтектике будут примешаны ранее выпавшие более крупные кристаллы Sb или Pb.
Итак, рассмотренная диаграмма плавкости делится на пять областей: I – расплав; II – расплав + кристаллы А (Sb); III – расплав + кристаллы В (Pb); IV –
8
смесь эвтектики (А + В) + кристаллы А; V – смесь эвтектики (А + В) + кристаллы В.
Кривая аЕв начала кристаллизации (конца плавления) называется линией ликвидуса, линия сЕd конца кристаллизации (начала плавления) – линией солидуса (или в данном случае эвтектической горизонталью).
Следовательно, диаграмма плавкости (состояния) представляет собой графическое изображение существующих фаз в зависимости от факторов равновесия. Их строение подчиняется правилу фаз. Применим правило фаз к диаграмме (рис. 2). Оно читается так: число степеней свободы С и число фаз Ф на два превышает число компонентов К:
С+ Ф = К + 2
Вэтом случае 2 – внешние факторы равновесия – давление и температура. Для металлических систем, когда рассматривается конденсированное
состояние, давление пара мало меняется и им можно пренебречь. Поэтому на смещение фазового равновесия влияет только температура. Следовательно, правило фаз в этом случае упрощается:
С + Ф = К + 1
Фазой называется совокупность всех однородных частей системы, обладающих одинаковым химическим составом и одинаковыми химическими свойствами, и отделённых от остальных частей системы поверхностью раздела.
Компонентом называется такая составная часть системы, которая является химически однородным веществом, может быть выделена из системы и может существовать в изолированном виде в течение длительного времени.
Известно, что равновесие системы зависит от условий (температуры, давления, концентрации). Число условий (число параметров состояния системы), которые можно изменить произвольно в известных пределах без изменения числа и вида фаз системы называется числом степеней свободы.
Определим число термодинамических степеней свободы С для разных областей диаграммы.
Равновесие двух фаз (области II, III, IV, V) в двухкомпонентной системе является одновариантным (C = K – Ф + 1 = 2 – 2 + 1).
Однофазное равновесие в двухкомпонентной системе (область 1) обладает вариантностью, равной двум. Это означает, что давление, которое мы принимаем за неизменный параметр, тоже можно было бы изменять одновременно с температурой без нарушения фазового равновесия.
Эвтектическое превращение в этой системе, осуществляющееся при трёхфазном равновесии, является безвариантным (С = К – Ф = 2 – 3 + 1 = 0), т. е. происходит при постоянной температуре и определённой концентрации компонентов (эвтектический состав).
9
1.4 Диаграмма плавкости с образованием химического (интерметаллического) соединения
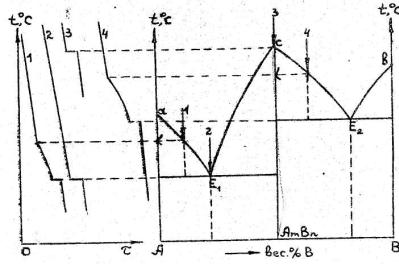
Рис. 3а.
Образуют интерметаллические соединения, как правило, металлы с резко различными свойствами; природа связи в них может меняться от чисто металлической до ионной (например, в ряду Mg2Pb, Mg2Sn, Mg2Ge, Mg2Si,
Mg2C).
Если при сплавлении металлов между ними образуется соединение, то на линии ликвидуса появляется максимум, абсцисса которого определяет состав интерметаллида. Абсцисса точки максимума (с) определяет содержание металлов А и В в интерметаллиде АmBn в массовых процентах.
Тогда m : n = |
масс.%А: |
масс.%В , |
|
МА |
МВ |
где МА и МВ – соответствующие молярные массы металлов А и В.
Такие диаграммы (рис. 3а) представляют собой как бы сочетание двух диаграмм с простой эвтектикой (рис. 2), разделённых по ординате химического
соединения АmBn.
Здесь две эвтектики Е1(А + АmBn) и Е2(В + АmBn); под кривыми Е1с и сЕ2 – область существования кристаллов химического соединения АmBn с расплавом
двух компонентов.
Кривая охлаждения сплава состава АmBn аналогична кривой охлаждения чистого компонента (кривая 3).
Острый максимум свидетельствует о прочности соединения: оно плавится без разложения (конгруэнтно). Так, легкоплавкие металлы могут дать тугоплавкий сплав, например, смесь Mg (t°пл. = 650,9°С) и Sb (t°пл. = 630°С) образуют сплав Mg3Sb2 с t°пл. = 961°С. Если же соединение при плавлении испытывает частичную диссоциацию, то максимум на линии ликвидуса
10
становится округлым. Если число максимумов на диаграмме плавкости больше одного, то это означает, что компоненты образуют несколько химических соединений.
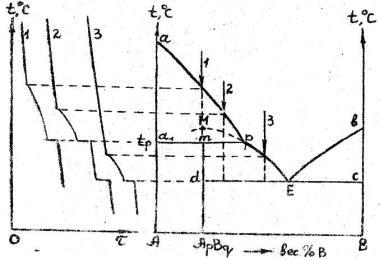
Для систем, образующих соединения, плавящиеся с разложением (инконгруэнтно), диаграмма имеет вид, изображённый на рис. 3б.
Рис. 3б.
Диаграмму этого типа называют иногда диаграммой плавкости со скрытым максимумом (М).
Линия арЕв – ликвидус. Прямые dЕс и а1mр – солидус. Прямая dЕс является эвтектической горизонталью и соответствует температуре кристаллизации эвтектики Е (мелкие кристаллы AрBq и В). Прямая а1mр носит название перитектической горизонтали или линии разрушения химического соединения и соответствует температуре, при которой происходит разрушение химического соединения при нагревании.
Рассмотрим процессы, происходящие при охлаждении сплава 1, состав которого соответствует эквивалентным количествам компонентов А и В согласно реакции:
рА + qВ = ApBq
Выше температуры tp химическое соединение разлагается на компоненты А и В. Как видно из диаграммы компонент А при температурах выше tp существует в виде твёрдой фазы, находящейся в равновесии с расплавом, содержащим компоненты А и В, т. е. жидкость сплава 1 выше температуры tp является насыщенной по отношению к кристаллам А и выделение этих кристаллов из жидкости будет первой стадией кристаллизации сплава 1. затем при постоянной температуре (tp) (согласно правилу фаз – это безвариантное превращение, т. к. С = К – Ф + 1 = 2 – 3 + 1 = 0) произойдёт растворение этих кристаллов А в расплаве состава, определяемого абсциссой перитектической точки (р) и одновременное выделение кристаллов нового типа – кристаллов
