- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
Практические работы
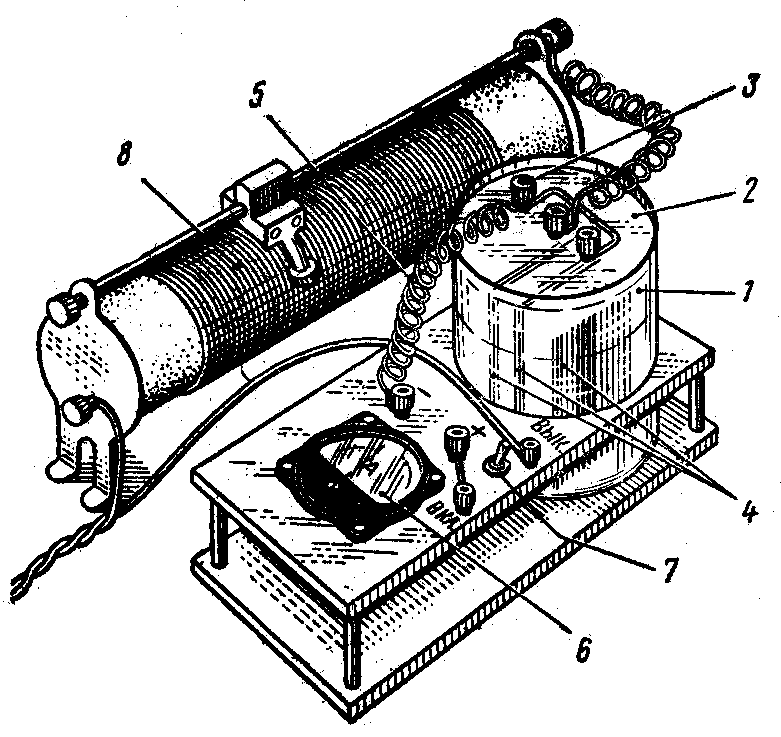
1. Нанесение медного покрытия на медной пластинке. Опыт проводится на установке, изображенной на рис. 11.
Условия электролиза:
Электролит: CuSO4·5H2O–150г/л; H2SO4–50 мл; С2Н5ОН–50 мл. рН=3,0-3,5.
В качестве анодов и катода – медные пластинки.
Поверхность образца S, дм2
Температура Т, °С.
Плотность тока J, А/дм2
Сила тока в цепи, А
Продолжительность процесса, мин.
К: Сu2++2е→Cu
A: Сu–2е→Cu2+
Налейте в батарейный стакан (1) электролит для меднения (4). Закрепите образец в изолирующей крышке (2) (рис. 11) и вставьте ее в стакан. Соберите по схеме установку, не присоединяя ее к источнику тока (7). Присоедините установку к источнику тока и включите секундомер. С помощью реостата (8) установите рассчитанную силу тока, поддерживая ее постоянной по гальванометру (6). По прошествии заданного времени выключите ток, извлеките образец из |
Рис. 11. Установка для нанесения гальванических покрытий. |
электролизера, промойте его водой, просушите фильтровальной бумагой и взвесив медную пластину (5), получите экспериментальное значение массы осажденной меди.
Теоретическое
значение массы определите по формуле
12.13, зная величину тока и времени процесса.
Сопоставьте теоретическое и
экспериментальное значение масс,
определите выход по току по формуле:![]() .
.
Результаты опыта:
Масса катода, г |
Масса покрытия, г |
||
до электролиза m1 |
после электролиза m2 |
опытная m3= m2- m1 |
теоретическая mтеор |
|
|
|
|
![]()
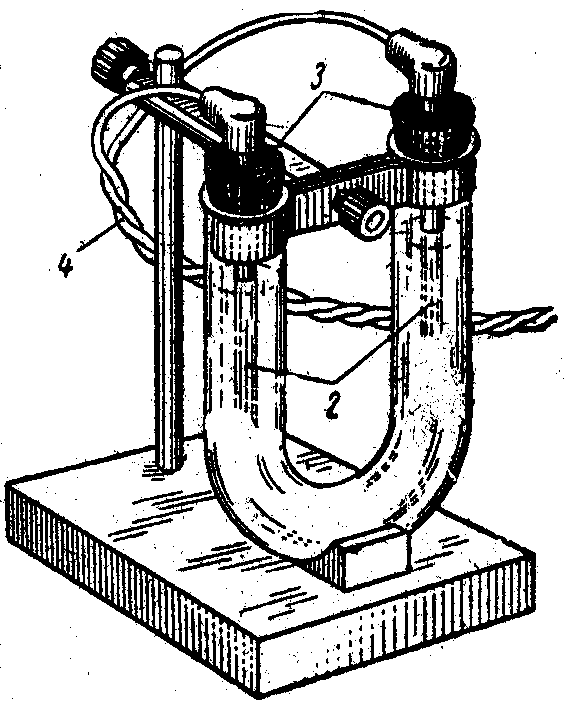
2. Электролиз водного раствора гидроксида натрия. Опыт проводится на установке аналогичной рис. 12 с насажанными на колена U-образного сосуда мерными бюретками для определения объемов выделяющихся газов. Каких? Составьте уравнения процессов протекающих на электродах (12.8, 12.10). Оцените возможности создания генераторов кислорода и водорода. |
Рис. 12. Установка для электролиза с нерастворимым анодом. |
12.3 Коррозия металлов и защита от коррозии
Технически не рентабельное, не целесообразное разрушение металлов под воздействием внешней среды называется коррозией. Ржавление – частный случай коррозии, когда разрушению подвергаются черные металлы, т.е. железо и его сплавы. В зависимости от характера внешней среды, с которой взаимодействует металл, различают два вида коррозии – химическую и электрохимическую.
При химической коррозии металл разрушается за счет химической реакции в средах, не проводящих электрический ток. Это коррозия в сухих газах и парах при высокой температуре и отсутствии влаги (газовая коррозия) или в жидкостях, не проводящих электрического тока (коррозия в неэлектролитах). Появление слоя окалины на деталях двигателя внутреннего сгорания, лопатках газовых турбин, металлах после термической обработки – есть результат химической коррозии.
Электрохимическая коррозия – коррозия в средах, проводящих электрический ток: в растворах электролитов, во влажной атмосфере с растворенными в ней газами, в почве и т. п. Этот вид коррозии имеет наибольшее распространение.
Согласно теории
микрогальванопар, причиной электрохимической
коррозии металлов является наличие на
их поверхностях микроскопических
короткозамкнутых гальванических
элементов, спонтанно возникающих
вследствие неоднородности металла и
его контакта с окружающей средой. На
поверхности любого металла, находящегося
в атмосфере, всегда существуют условия
для построения гальванического элемента.
В тонком слое влаги, всегда имеющемся
на поверхности металла, растворяются
СО2,
SO2
и другие газы, присутствующие в воздухе.
Это создает условия для соприкосновения
металла с электролитом. С другой стороны,
различные участки поверхности данного
металла обладают разными потенциалами.
Причины этого разнообразны, например,
разность потенциалов между различно
обработанными частями поверхности,
разными структурными составляющими
сплава, примесями и основным металлом
и т. д. При этом, очевидно, участки
поверхности образца металла с более
электроотрицательным потенциалом
становятся анодами и растворяются. Если
имеется контакт какого-либо металла со
сплавом и возникла коррозия, то сплав
приобретает потенциал соответствующий
потенциалу наиболее отрицательного
металла, входящего в его состав. При
контакте латуни с железом корродировать
станет латунь (за счет наличия в ней
цинка). Очень часто электрохимическая
коррозия возникает в результате различной
аэрации, т. е. неодинакового доступа
кислорода воздуха к отдельным участкам
поверхности металла. На рис. 13 изображен
случай коррозии железа под каплей воды.
Около краев капли, куда кислороду
проникнуть легче, в
Рис. 13. Схема
коррозии
железа под каплей
воды.
Рис. 14. Схема
электрохимической
коррозии
(Д – деполяризатор).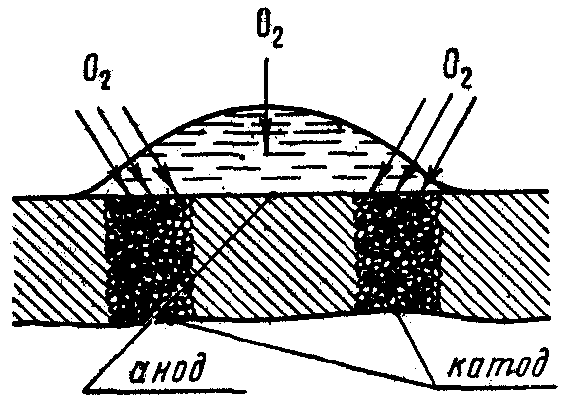

На практике наиболее часто встречается коррозия с водородной деполяризацией (12.14) и коррозия с кислородной деполяризацией (12.15).
Н++е=Н, Н+Н= Н2 (12.14) 2Н2О+О2+4е=4ОН– (12.15)
Реакция (12.14) протекает на катодных участках в случае электрохимической коррозии в кислой среде, реакция (12.15) – в нейтральной и щелочной. Особенно широко распространен процесс коррозии с кислородной деполяризацией. Он наблюдается в случае коррозии металлов в воде, почве и т. д. Примером может служить ржавление железа во влажном воздухе, при котором продуктом коррозии является гидрат закиси железа, постепенно окисляющийся до гидрата окиси железа:
на аноде 2Fe–4е=2Fe2+ (12.16)
на катоде 2Н2О+О2+4е=4ОН– (12.17)
в итоге 2Fe2++4ОН–=2Fe(ОН)2 (12.18)
4Fe(ОН)2+2Н2О+О2=4Fe(ОН)3 (12.19)
Основная масса черных металлов разрушается вследствие протекания этих реакций и образования Fe2О3× Н2О – бурой ржавчины.
Причины, вызывающие коррозионное разрушение металлов, многочисленны. Разнообразны и методы защити от коррозии: обработка внешней среды, в которой протекает коррозия; защитные покрытия; электрохимическая защита; изготовление специальных коррозионно устойчивых сплавов из черных и цветных металлов. Сущность метода обработки внешней среды заключается в удалении или понижении активности некоторых находящихся в ней веществ, вызывающих коррозию. Например, если причиной коррозии является растворенный в воде кислород, то его удаление предохранит металл от разрушения. Процесс удаления кислорода называется деаэрацией. Иногда в раствор добавляют специальные замедляющие коррозию вещества, которые называются замедлителями, или ингибиторами.
Роль защитных покрытий сводится в основном к изоляции металла от воздействия внешней среды. Это достигается нанесением на поверхность металла лаков, красок, гальванических покрытий и т. д. Металлические покрытия по характеру защитного действия делятся на анодные и катодные. В случае анодного покрытия стандартный электродный потенциал покрывающего металла более отрицателен, чем потенциал защищаемого металла (например, оцинкованное железо). В случае катодного покрытия стандартный электродный потенциал покрывающего металла более положителен, чем потенциал основного металла (например, луженое железо).
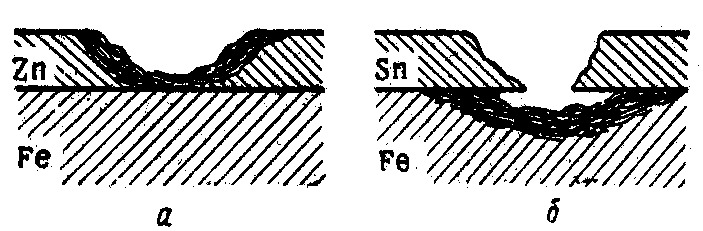
Пока защитный слой полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодным и катодным покрытиями нет. При нарушении же целостности покрытия возникают новые условия (рис. 15). Катодное покрытие (олово на железе) в этом случае не только перестанет защищать основной металл, но усиливает своим присутствием коррозию железа (в возникшем гальваническом элементе железо является анодом). Анодное покрытие (цинк на железе), наоборот, при нарушении целостности покрывающего слоя будет само подвергаться разрушению, защищая тем самым основной металл от коррозии (в возникшем гальваническом элементе цинк является анодом).
При перемене среды электродный потенциал у отдельных металлов (табл. 8 приложения) может меняться. Хром, никель и другие металлы, стандартный электродный потенциал которых отрицателен, в обычных атмосферных условиях сильно пассивируются (покрываются окисной пленкой), вследствие чего их потенциал становится положительным. При электрохимической защите уменьшение или полное прекращение коррозии достигается созданием на защищаемом металлическом изделии более высокого потенциала. Для этого защищаемое изделие или соединяют проводником с металлом, имеющим высокий электроотрицательный потенциал (способным легко отдавать электроны), или с отрицательным полюсом внешнего источника тока. В первом случае защита носит название протекторной, во втором – катодной.
И
Рис. 15. Коррозия
железа при нарушении металлических
покрытий:
а – оцинкованное
(анодное покрытие); б – луженое (катодное
покрытие).