
- •1.Загальна частина
- •1.1.Розподіл навчальних годин курсу Фізична хімія у дев’ятому тетраместрі
- •1.2. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •1.3. Тематичний план та зміст лекційного курсу
- •1.4.Індивідуальні та домашні завдання для самостійної роботи студентів
- •2.Домашні розрахункові завдання.
- •2.1.Завдання 7. Формальна кінетика. Необоротні (односторонні) реакції n-х порядків.
- •Загальний тиск в кожний момент часу дорівнює
- •2.2.1.Завдання 8а. Послідовні реакції
- •2.2.1.1.Приклад розв’язання задачі
- •2.2.2.Завдання 8б. Паралельні реакції
- •Вихідні дані до завдання 8б
- •2.2.2.1.Приклад розв’язання задачі
- •2.3.Завдання 9. Залежність швидкості хімічної реакції від температури
- •2.3.1.Приклад розв’язання задачі
- •2.4. Завдання 10. Кінетика гетерогенних процесів
- •Вихідні дані до завдання 10
- •2.4.1.Приклад розв’язання задачі:
- •3.Перелік КонтрольнИх питанЬ для підготовки до контрольних робіт та іспиту
- •3.1. Формальна кінетика. Необоротні (односторонні) реакції n-х порядків
- •3.2. Формальна кінетика. Складні реакції 1-го порядку
- •3.3. Залежність швидкості хімічної реакції від температури
- •3.4. Теорії хімічної кінетики
- •3.5. Мономолекулярні реакції та реакції у розчинах
- •3.6. Ланцюгові, фотохімічні та радіаційно-хімічні реакції
- •3.7. Гомогенний каталіз
- •3.8. Гетерогенна кінетика. Гетерогенний каталіз
- •3.9. Електрохімічна кінетика
- •4.Нарахування рейтингових балів
- •4.1.Правила нарахування рейтингових балів
- •5.Список рекомендованої літератури
2.3.1.Приклад розв’язання задачі
До
п 1:.Енергію
активації реакції знаходимо за
інтегральною формулою, яка походить з
рівняння Ареніуса:
![]() ,
,
![]() (24)
(24)
![]()
До п.2: Передекспоненційний множник можна розрахувати за експоненційною формою рівняння Ареніуса:
![]() (25)
(25)
![]() (26)
(26)
Обчислюємо k0 при двох температурах (значення повинні бути близькими) і знаходимо середнє значення:
![]()
![]()
Тобто: k0 = 1,306 1018 дм3/(хвмоль)
До п.3: Для обчислення константи швидкості даної реакції за Т3 також використаємо інтегральну форму рівняння Арреніуса (24):
![]()
![]()
До п.4: Дана реакція (вар.25) є реакцією 1-го порядку. Тому кількість вихідної речовини, що прореагувала за час , обчислюємо за формулою:
![]() моль/дм3.
моль/дм3.
До п. 5: Температурний коефіцієнт швидкості реакції обчислюємо за правилом Вант-Гофа:
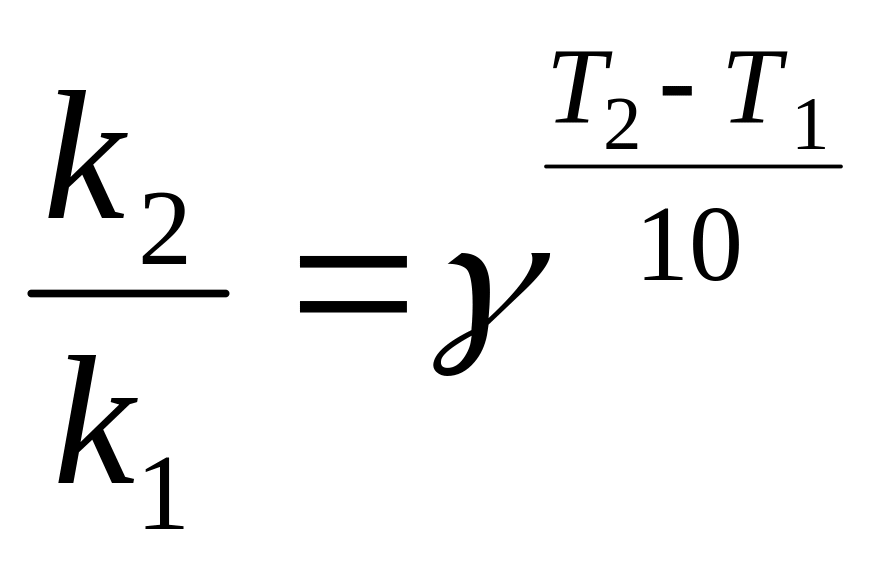 (27)
(27)
![]() ;
;
![]()
До п. 6: Для того, щоб розрахувати, у скільки разів зросте швидкість реакції при підвищенні температури на 25 К, треба знайти відношення kT+25/kT за формулою Вант-Гофа(27), якщо правило виконується, або за інтегральною формулою Ареніуса (24).
Дана реакція підпорядковується правилу Вант-Гофа, тому:
kT+25/kT = γ 2,5 = 3,592,5 = 24,48 разів.
2.4. Завдання 10. Кінетика гетерогенних процесів
Гранична розчинність речовини А у воді при температурі t1 дорівнює Снас (табл. 3.7). За час 1 у посудині, що містить V (дм3) води, розчинилося n1 моль речовини А. Швидкість процесу розчинення контролюється стадією дифузії. Певне значення товщини дифузійного шару () підтримується перемішуванням розчину зі сталою швидкістю. Площа поверхні границі поділу фаз у ході досліду залишається постійною (S = const).
1. Визначити константу швидкості процесу розчинення речовини А за рівнянням Щукарева (хв-1).
2. Визначити кількість речовини А, що розчиниться за час τ2 від початку процесу та побудувати графік залежності концентрації речовини А у розчині від часу, що пройшов з початку розчинення.
3. Розрахувати величину коефіцієнту масопереноса D/ (см/с).
4. Визначити швидкість розчинення (г/(см3)) у момент часу 2.
(Густину чистої води і розчину А прийняти рівною 1 г/см3. Зміною глейкості розчину в ході процесу розчинення знехтувати).
Таблиця 2.9
Вихідні дані до завдання 10
Варі-ант |
Речовина А |
t1, С |
Снас, г/100 г H2O |
1, хв |
V, дм3 |
n1, моль |
S, см2 |
2, хв |
1 |
BaSO4 |
20 |
210-2 |
10 |
1 |
1,2910-4 |
2 |
28 |
2 |
Ca(OH)2 |
30 |
0,153 |
100 |
1 |
1,3510-3 |
1 |
250 |
3 |
HgI2 |
20 |
5,9110-3 |
8 |
1 |
4,410-7 |
3,5 |
16 |
4 |
K2SiF6 |
20 |
0,12 |
15 |
1 |
5,110-4 |
4 |
4 |
5 |
PbCrO4 |
20 |
4,310-6 |
20 |
2 |
2,4810-9 |
2,5 |
35 |
6 |
TlBrO3 |
20 |
3,4610-2 |
20 |
2 |
6,010-6 |
1 |
60 |
7 |
PbI2 |
20 |
6,810-2 |
7 |
2 |
2,710-5 |
3,5 |
24 |
8 |
CaSO4 |
10 |
0,1928 |
6 |
2 |
1,3210-3 |
18 |
18 |
9 |
PbSO4 |
30 |
4,910-3 |
12 |
2 |
3,310-6 |
6 |
25 |
10 |
(NH4)2C2O4 |
10 |
3,2 |
5 |
1 |
2,410-3 |
2 |
15 |
11 |
Li3PO4 |
20 |
3,910-2 |
3 |
1 |
5,1610-6 |
1 |
10 |
12 |
Na2SiF6 |
0 |
0,43 |
3 |
1 |
5,310-4 |
4 |
33 |
13 |
RbClO4 |
0 |
0,5 |
4 |
1 |
3,2510-4 |
5,5 |
28 |
14 |
Hg2Cl2 |
0 |
1,410-4 |
10 |
1 |
1,510-7 |
2,5 |
26 |
15 |
PbI2 |
30 |
9,010-2 |
9 |
2 |
1,310-5 |
7 |
32 |
16 |
BaSiF6 |
20 |
2,610-2 |
14 |
2 |
710-5 |
5 |
5 |
17 |
CaSO4 |
30 |
0,209 |
13 |
2 |
1,510-3 |
9 |
55 |
18 |
Na2SiF6 |
20 |
0,73 |
20 |
2 |
8,210-4 |
2 |
80 |
19 |
TlBrO3 |
40 |
7,3610-2 |
6 |
2 |
5,4310-5 |
1,5 |
54 |
20 |
Ag2SO4 |
10 |
0,69 |
4 |
1 |
9,610-4 |
20 |
28 |
21 |
PbSO4 |
10 |
3,510-3 |
2 |
1 |
9,910-7 |
2 |
44 |
22 |
Ag2SO4 |
30 |
0,88 |
11 |
1 |
3,210-4 |
3 |
55 |
23 |
Hg2Cl2 |
20 |
2,010-4 |
18 |
1 |
1,310-7 |
1,5 |
3 |
24 |
(NH4)2C2O4 |
20 |
4,5 |
10 |
1 |
710-3 |
6 |
48 |
25 |
PbSO4 |
40 |
5,610-3 |
7 |
2 |
2,410-6 |
5 |
26 |
