
- •Практикум по физической химии Екатеринбург 2003 г Введение
- •1. Термохимия.
- •1.1. Краткая теория.
- •1.2 Экспериментальная часть.
- •1.2.1. Аппаратура
- •1.2.2. Определение постоянной калориметра.
- •1.3. Лабораторная работа 1. Определение теплоты растворения металлического магния Mg в растворе соляной кислоты hCl.
- •1.4. Лабораторная работа 2. Определение теплоты образования кристаллогидрата сульфата меди CuSo45h2o.
- •2. Термодинамика фазовых переходов.
- •2.1. Краткая теория. Однокомпонентная система.
- •2.2. Лабораторная работа 3. Определение теплоты испарения жидкости динамическим методом
- •3. Гетерогенное химическое равновесие.
- •3.1. Краткая теория
- •3.2. Лабораторная работа 4. Определение константы равновесия и расчет основных термодинамических величин реакций разложения оксидов никеля и кобальта.
- •4. Диаграммы состояния двухкомпонентных систем.
- •4.1. Краткая теория.
- •4.2. Лабораторная работа 5. Построение диаграммы состояния бинарной системы фенол-нафталин.
- •5. Растворы.
- •5.1. Краткая теория
- •5.1. Лабораторная работа 6. Построение диаграммы состояния бинарного раствора.
- •6. Электропроводность растворов электролитов.
- •6.1. Краткая теория
- •6.2. Лабораторная работа 7. Электропроводность растворов электролитов.
- •6.3. Лабораторная работа 8. Числа переноса в растворах электролитов.
- •7. Электрохимическое равновесие электрод-электролит
- •7.1. Краткая теория
- •7.2. Лабораторная работа 9. Измерение электродных потенциалов и эдс гальванических элементов.
- •8. Химическая кинетика
- •8.1. Краткая теория
- •8.2. Лабораторная работа 10. Определение скорости реакции омыления уксусноэтилового эфира.
- •9. Напряжение разложения растворов электролитов. Основы электрохимичесКой кинетиКи
- •9.1. Краткая теория
- •9.2. Лабораторная работа11. Определение напряжения разложения растворов электролитов.
- •Литература
7. Электрохимическое равновесие электрод-электролит
7.1. Краткая теория
При рассмотрении равновесий на границе фаз с участием заряженных частиц фундаментальное значение имеет понятие электрохимического потенциала. Полный дифференциал энергии Гиббса системы, содержащей заряженные частицы можно представить в виде:
![]() , (7.1)
, (7.1)
где S – энтропия, V – объем системы, – электрический потенциал в той части системы, где находится частица i-сорта, zi – заряд частицы. Уравнение (7.1) несложно преобразовать к виду:
![]() (7.2)
(7.2)
где
![]() носит название электрохимического
потенциала частиц i-сорта.
носит название электрохимического
потенциала частиц i-сорта.
Условием равновесия в системе с заряженными частицами является равенство электрохимических потенциалов частиц каждого сорта во всех сосуществующих фазах. Так, например, на границе металла М с раствором, содержащим ионы этого же металла при установлении равновесия происходит выравнивание электрохимических потенциалов ионов Мz+ в растворе и в кристаллической решетке металла:
Мz+ (металл) Мz+ (раствор). (7.3)
При равновесии:
![]() или
или
![]() . (7.4)
. (7.4)
Так что гальвани-потенциал на границе металл–раствор соответствующей соли имеет вид:
![]() . (7.5)
. (7.5)
Используя известное соотношение зависимости химического потенциала от активности:
![]() , (7.6)
, (7.6)
уравнение (7.5) несложно преобразовать к виду:
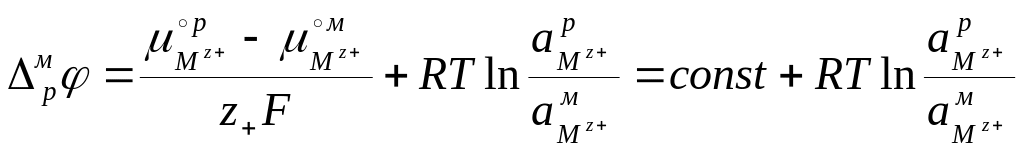 . (7.7)
. (7.7)
В случае если в
качестве электрода взят химически
чистый металл, то его активность
![]() и уравнение (7.7) упрощается:
и уравнение (7.7) упрощается:
![]() . (7.8)
. (7.8)
Уравнение аналогичное (7.8), в которое, однако, вместо активности входила концентрация ионов в растворе, было впервые получено Нернстом. Уравнение (7.8) – это частный случай уравнения Нернста для отдельного гальвани-потенциала.
Экспериментально можно определить потенциал электрода только относительно какого-либо, взятого за электрод сравнения, т.е. разность потенциалов двух электродов, но не потенциал каждого из них. Обычно в качестве условного нуля выбирают потенциал водородного электрода при активности ионов водорода равной единице и давлении газообразного водорода равном 1 атм.
Согласно конвенции, принятой Международным союзом по чистой и прикладной химии (Стокгольм, 1953), схема электрохимической системы записывается следующим образом: сначала указывается материал одного из двух, образующих ее электродов, затем примыкающий к нему раствор, далее раствор, контактирующий со вторым электродом, и, наконец, материал второго электрода. При такой схематической записи электрод отделяется от раствора одной вертикальной чертой, а различные растворы – двумя сплошными вертикальными чертами, если диффузионный потенциал между ними полностью устранен, и пунктирной вертикальной прямой – если он остается. Если электрод (или раствор) содержат несколько различных веществ, то их перечисляют, разделяя запятыми. Так, например, следующая запись:
Pt, H2 HCl║CuSO4Cu (7.9)
отвечает системе, составленной из водородного электрода, погруженного в раствор соляной кислоты, и металлической меди, опущенной в раствор сульфата меди. Водородный электрод представляет собой металлическую пластину (обычно с развитой поверхностью), омываемую газообразным водородом и опущенную в раствор, содержащий ионы водорода.
ЭДС системы равно потенциалу правого электрода, при условии, что потенциал левого электрода принят за нуль. Т.е. условный электродный потенциал – это ЭДС системы, в которой справа расположен данный электрод, а слева стандартный водородный электрод. ЭДС и электродный потенциал определяется для такой цепи как:
E = прав - лев = . (7.10)
ЭДС системы считается положительной, если электрический ток внутри цепи течет слева направо; при противоположном направлении тока ей приписывают отрицательное значение. Реакцию, протекающую в системе (7.9), записывают следующим образом:
H2 + Cu2+ = 2H+ + Cu (7.11)
Реакция, отвечающая потенциалу медного электрода, должна быть записана:
Cu2+ + 2e = Cu (7.12)
Из опыта известно, что в элементе (7.9) электричество течет слева направо, и, следовательно, ЭДС и условный электродный потенциал медного электрода положительны. В элементе, составленном из водородного и цинкового электродов, ЭДС которого соответствует условному потенциалу последнего в водородной шкале:
Pt, H2 HCl║ZnSO4Zn (7.13)
положительное электричество течет справа налево, и, следовательно, они отрицательны. При составлении цепи:
Zn ZnSO4║ HCl H2, Pt (7.14)
положительное электричество будет протекать слева направо и ЭДС будет положительной, но она уже не будет соответствовать электродному потенциалу цинка.
Уравнение Нернста для вычисления условного потенциала медного и цинкового электродов запишутся соответственно:
 (7.15)
(7.15)
 (7.16)
(7.16)
где
![]() и
и
![]() значения стандартных электродных
потенциалов.
значения стандартных электродных
потенциалов.
ЭДС – важная характеристика гальванического элемента. Из уравнения (7.5) несложно показать, что ЭДС непосредственно связано с термодинамическими свойствами системы:
G = nFE (7.17)
Из связи энергии Гиббса с другими термодинамическими функциями несложно получить другие уравнения. Температурный коэффициент ЭДС характеризует изменение энтропии S в ходе данной реакции:
![]() , (7.18)
, (7.18)
а по уравнению Гиббса-Гельмгольца можно связать ЭДС с тепловым эффектом химической реакции Н:
![]() . (7.19)
. (7.19)
Стандартное значение ЭДС элемента (E0) связано с константой равновесия химической реакции Кр уравнением:
![]() . (7.20)
. (7.20)
По значению ЭДС соответствующего гальванического элемента можно определить число переноса иона, заряд иона, произведение растворимости труднорастворимой соли, ионное произведение воды, коэффициент активности электролита, рН раствора электролита и другие величины. ионов
Так для измерения рН часто используют электрод, обратимый по отношению к системе хинонгидрохинон (х, гх). Равновесие в этой системе описывается следующей реакцией:
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2. (7.21)
Потенциалу этого электрода отвечает уравнение:
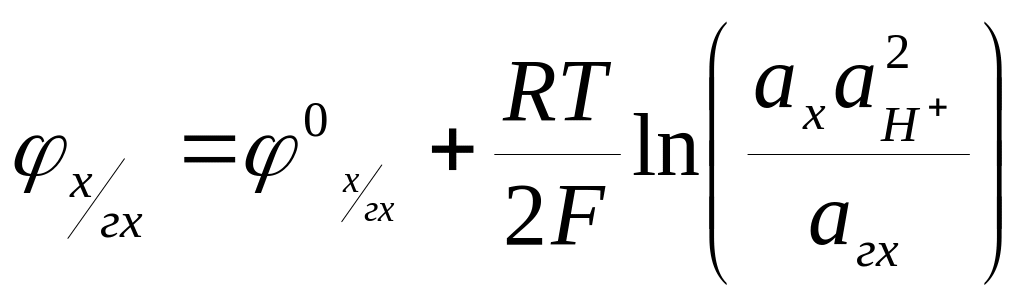 (7.22)
(7.22)
или
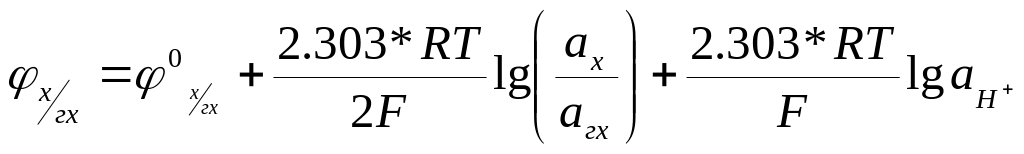 (7.23)
(7.23)
В раствор, рН которого хотят измерить, вводят эквимолярную смесь хинона и гидрохинона. Если считать, что отношение концентраций равно отношению активностей
![]() , (7.24)
, (7.24)
то уравнение (7.23) упрощается:
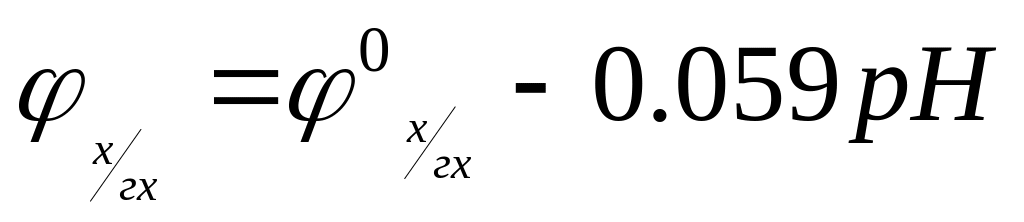 (7.25)
(7.25)
и потенциал такого электрода, называемого обычно хингидронным, будет определяться непосредственно величиной рН раствора.
Часто в качестве электрода сравнения используют, так называемый, хлор-серебрянный электрод, относящийся к электродам второго рода (металл, покрытый слоем его труднорастворимой соли и погруженный в раствор, содержащий тот же анион, что и труднорастворимое соединение). Схематически он может быть представлен следующим образом:
Cl-AgCl, Ag. (7.26)
Равновесие на электроде выражается реакцией:
AgCl + e = Ago + Cl-, (7.27)
а его потенциалу отвечает уравнение:
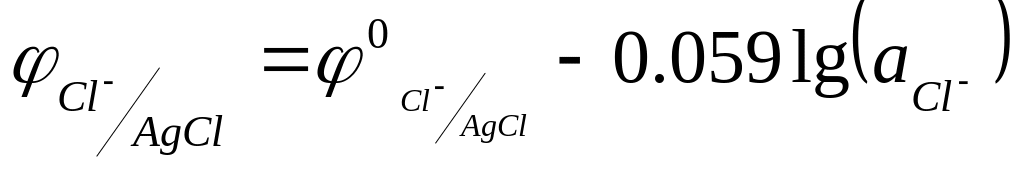 (7.28)
(7.28)
