
- •З.Н. Есина практикум по физике Учебное пособие Кемерово 2010
- •Предисловие
- •Раздел I.Физические основы механики
- •1.1. Основные формулы
- •19. Связь разности фаз колебаний с расстоянием между точками среды , отсчитанными в направлении распространения колебаний ,
- •1.2. Примеры решения задач
- •1.3. Задачи для самостоятельного решения
- •Раздел II.Молекулярная физика. Термодинамика
- •2.1. Основные формулы
- •2.2. Примеры решения задач
- •2.3. Задачи для самостоятельного решения
- •Раздел III.Электростатика. Постоянный ток
- •3.1. Основные формулы (в единицах си)
- •3.2. Примеры решения задач
- •З.З. Задачи для самостоятельного решения
- •Раздел IV.Электромагнитизм
- •4.1. Основные формулы
- •4.2. Примеры решения задач
- •4.3. Задачи для самостоятельного решения
- •Раздел V.Оптика
- •5.1. Уравнения и формулы
- •5.2. Примеры решения задач
- •5.3. Задачи для самостоятельного решения
- •Литература
- •Справочные таблицы
- •1. Основные физические постоянные
- •2. Диэлектрическая проницаемость
- •3. Удельное сопротивление проводников
- •4. Плотность твёрдых тел
- •5. Плотность жидкостей
- •11. Массы атомов лёгких изотопов
- •12. Масса и энергия покоя некоторых частиц
- •13. Единицы си, имеющие специальные наименования
- •14. Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
2.2. Примеры решения задач
Пример 1. Определить число N молекул, содержащихся в объеме V = 1 мм3 воды, массу молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение: Число N молекул,
содержащихся в некоторой массе равно
произведению числа Авогадро
![]() на количество вещества
:
на количество вещества
:
![]()
так как количество вещества:
![]()
μ - молярная масса, то
![]()
Выразив в этой формуле массу, как
произведение плотности
![]() на объем V, получим
на объем V, получим
![]() . (1)
. (1)
Подставим в формулу (1) следующие значения величин: = 103 кг/м3,
V = 1 мм3
=
![]() м
м![]() ,
μ =
,
μ =
![]() кг/моль,
=
кг/моль,
=![]() моль
моль![]() и произведем вычисления:
и произведем вычисления:
![]() молекул
= 3,34 1019молекул.
молекул
= 3,34 1019молекул.
Массу
,
одной молекулы можно найти делением
молярной массы на число Авогадро:
![]()
Подставим сюда числовые значения μ и и найдем массу молекулы воды:
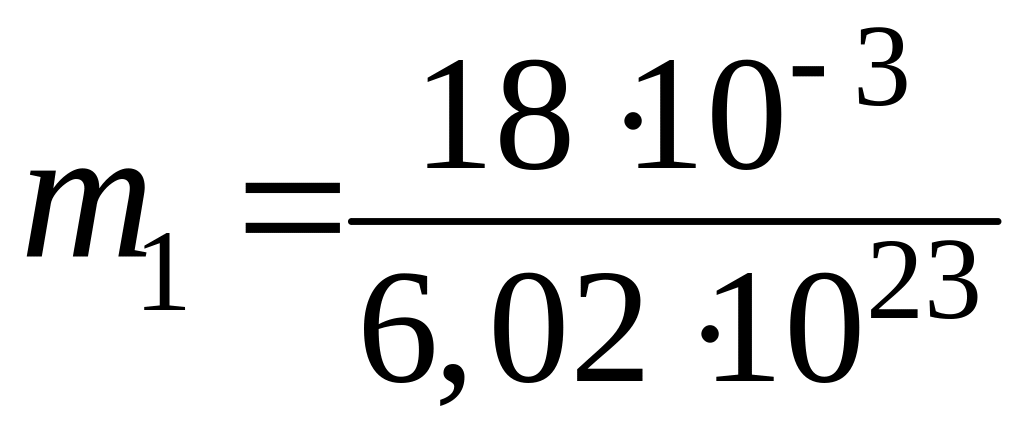 кг =
кг =
![]() кг.
кг.
Если молекулы воды плотно прилегают
друг к другу, то можно считать, что на
каждую молекулу приходится объем
(кубическая ячейка)
![]() ,
где d - диаметр
молекулы воды. Отсюда
,
где d - диаметр
молекулы воды. Отсюда
![]() (2)
(2)
Объем
![]() найдем, разделив молярный объем
найдем, разделив молярный объем
![]() на число молекул в моле, т.е. на число
Авогадро
:
на число молекул в моле, т.е. на число
Авогадро
:
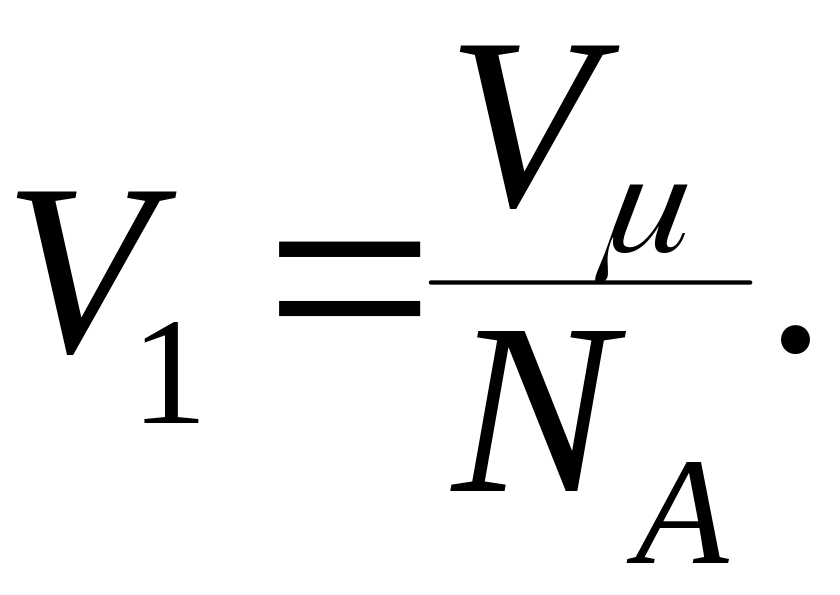
Подставим полученное выражение в формулу (2):
Входящий в эту формулу молярный объем
определяется выражением
![]() ,
тогда искомый диаметр молекулы:
,
тогда искомый диаметр молекулы:
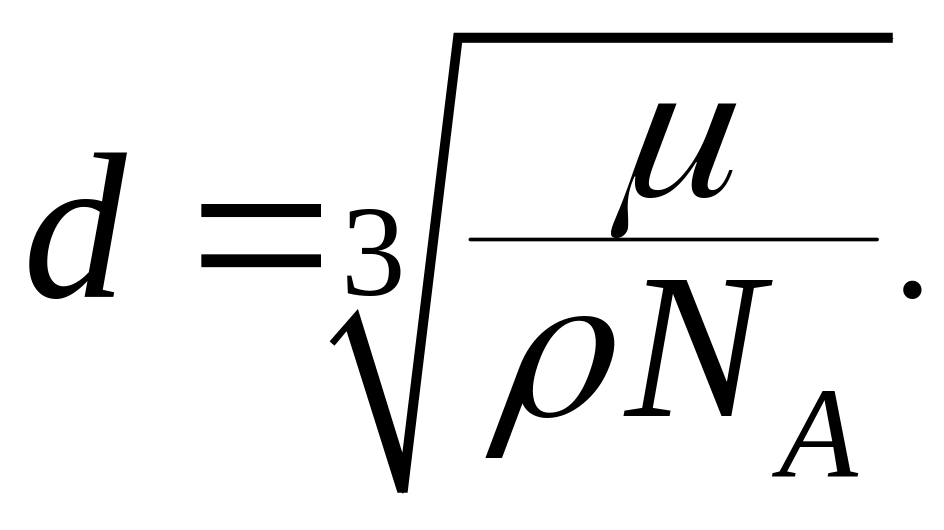 (3)
(3)
Проверим, дает ли правая часть выражения (3) единицу длины:
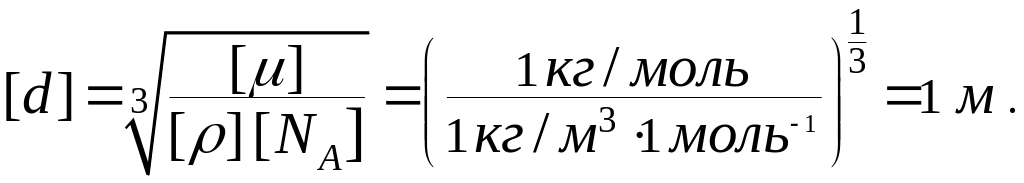
Теперь подставим числовые значения физических величин в формулу (3) и произведем вычисления:
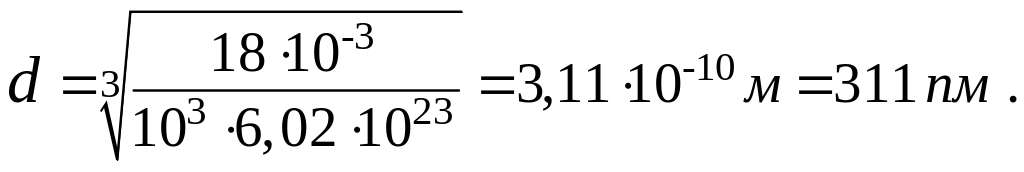
Пример 2. В баллоне объемом V =
10 л находится гелий под давлением
Р![]() = 1 МПа и при температуре Т
= 300 К. После того, как из баллона
было взято m = 10 г
гелия, температура в баллоне понизилась
до Т
= 1 МПа и при температуре Т
= 300 К. После того, как из баллона
было взято m = 10 г
гелия, температура в баллоне понизилась
до Т![]() = 290 К. Определить давление Р
гелия, оставшегося в баллоне.
= 290 К. Определить давление Р
гелия, оставшегося в баллоне.
Решение: Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа:
![]() (1)
(1)
где - масса гелия в баллоне в конечном состоянии, μ - молярная масса гелия, R - универсальная газовая постоянная. Из уравнения (1) выразим искомое давление Р .
![]() (2)
(2)
Массу гелия m2 выразим через массу m1, соответствующую начальному состоянию и массу m гелия, взятого из баллона:
![]() (3)
(3)
Массу гелия m найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию
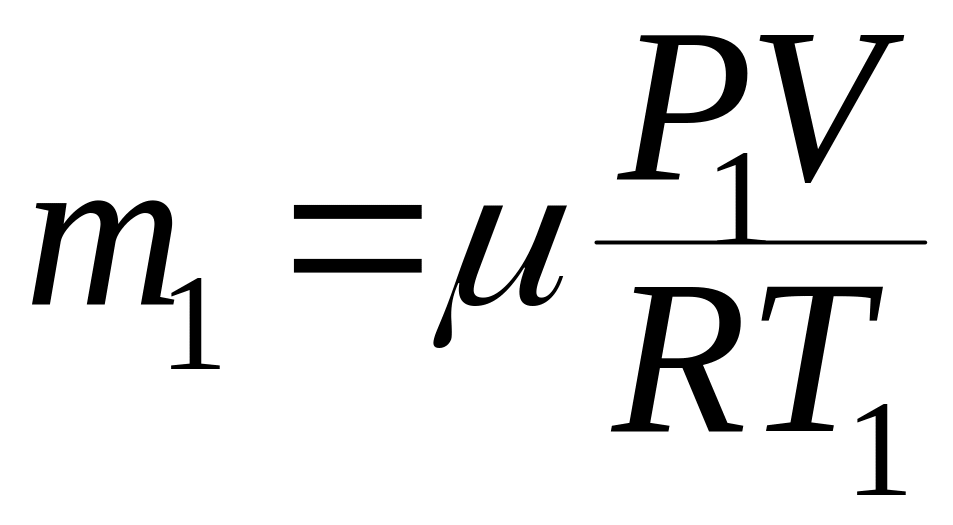 (4)
(4)
Подставляя в выражение (3) массу из формулы (4), а затем полученное выражение в формулу (2), найдем:
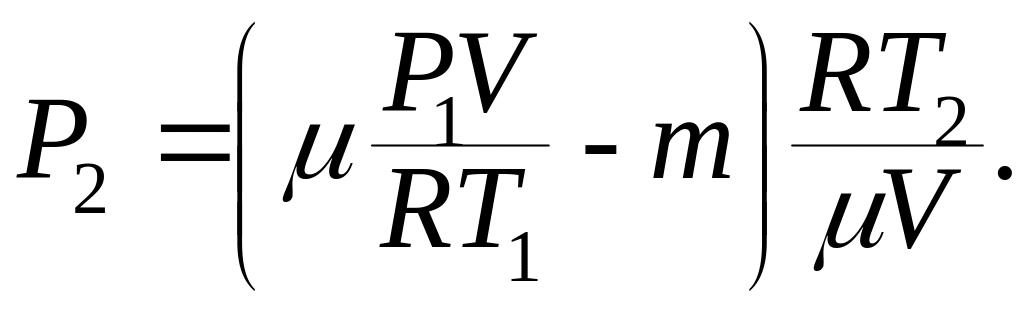
После преобразования и сокращения находим:
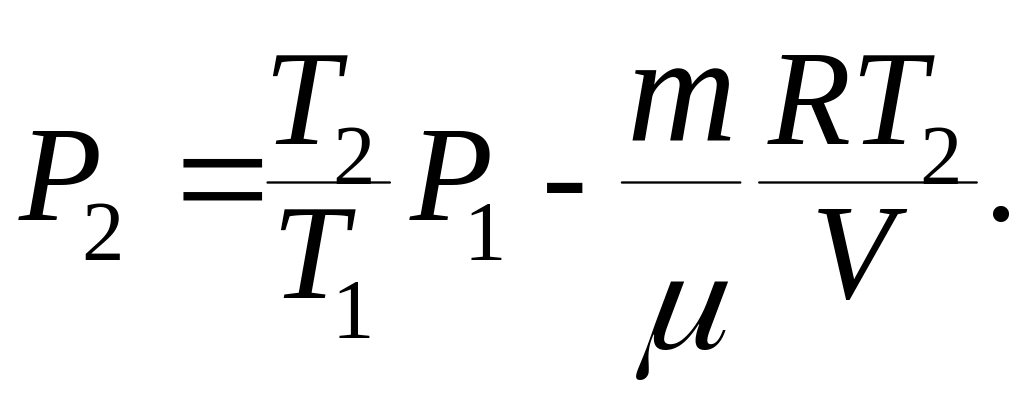 (5)
(5)
Левая часть расчётной формулы (5) выражает
давление, имеет размерность
![]() .
Проверим размерность правой части.
Размерность первого слагаемого не
вызывает сомнения, т.к. отношение
температур – величина безразмерная.
Размерность второго слагаемого:
.
Проверим размерность правой части.
Размерность первого слагаемого не
вызывает сомнения, т.к. отношение
температур – величина безразмерная.
Размерность второго слагаемого:
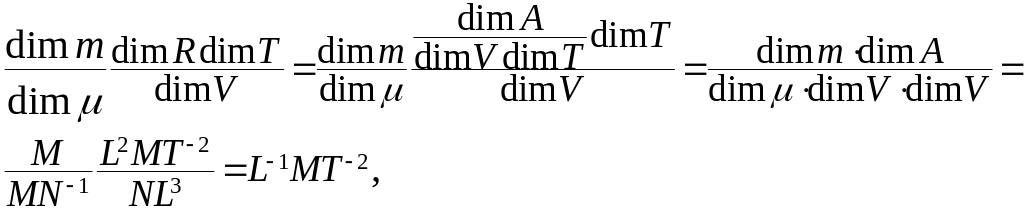
что совпадает с размерностью давления.
Убедившись в том, что размерность правой и левой частей формулы (5) одинаковы, выразим величины, входящие в эту формулу, в единицах СИ и произведем вычисления:
P1 = 1 МПа
=106 Па,
![]() ,
,
![]() ,
,
R = 8,31 Дж/(мольК), T1 = 300 К, T2 = 290 К,
V = 10 л = 10-2 м3,
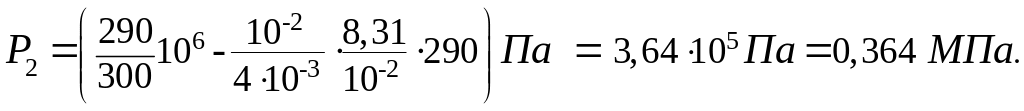
Пример 3. Баллон содержит = 80 г кислорода и = 320 г аргона. Давление смеси Р = 1 МПа, температура Т = 300 К. Принимая данные газа за идеальные, определить объем V баллона.
Решение. По закону Дальтона давление
смеси равно сумме парциальных давлений
газов, входящих в состав смеси.
Парциальным давлением газа называется
давление, которое производил бы этот
газ, если бы только он один находился
в сосуде, занятым смесью. По уравнению
Менделеева-Клапейрона, парциальные
давления кислорода
и аргона
![]() выражается формулами:
выражается формулами:
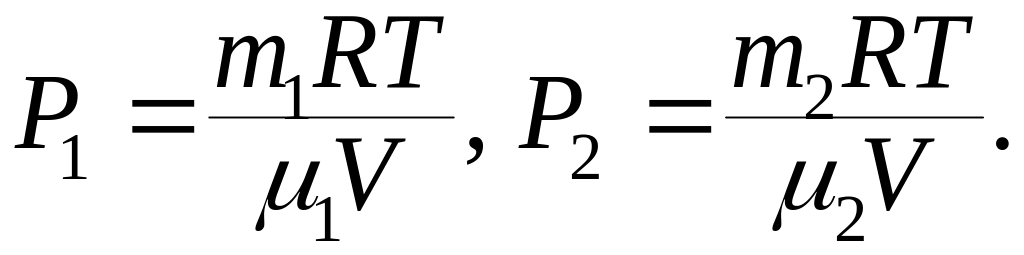
Следовательно, по закону Дальтона давление смеси газов
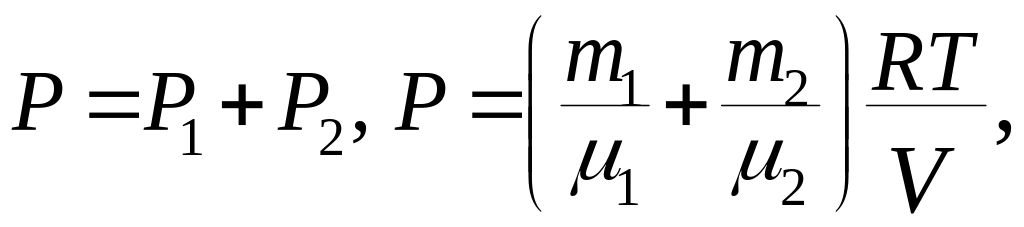
откуда объем баллона:
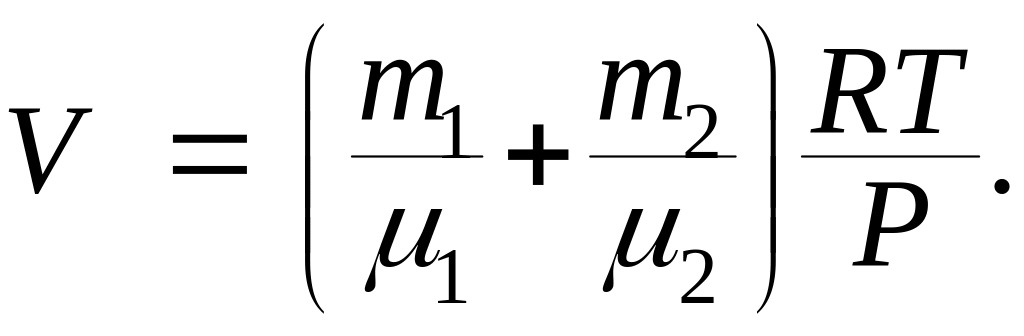
Выразим в единицах СИ числовые значения
величин, входящих в эту формулу m1
= 80 г = 0,8 кг,
![]() ,
m2 = 330 г
= 0,33 кг,
,
m2 = 330 г
= 0,33 кг,
![]() ,
2 = 40
10-3 кг/моль, P1
= 1 МПа = 106 Па, R
= 8,31 Дж/(мольК), подставим числовые
значения в формулу и произведем
вычисления:
,
2 = 40
10-3 кг/моль, P1
= 1 МПа = 106 Па, R
= 8,31 Дж/(мольК), подставим числовые
значения в формулу и произведем
вычисления:
![]()
Пример 4. Найти среднюю кинетическую
энергию
![]() вращательного движения одной молекулы
кислорода при температуре Т = 350
К, а также кинетическую энергию
вращательного движения одной молекулы
кислорода при температуре Т = 350
К, а также кинетическую энергию
![]() вращательного движения всех молекул
кислорода массой m =
4 г.
вращательного движения всех молекул
кислорода массой m =
4 г.
Решение: Известно, что на каждую
степень свободы молекулы газа приходится
одинаковая средняя энергия
 ,
где
- постоянная Больцмана, Т - абсолютная
температура газа. Так как вращательному
движению двухатомной молекулы (молекула
кислорода двухатомная) соответствует
две степени свободы, то средняя энергия
вращательного движения молекулы
кислорода выразится формулой:
,
где
- постоянная Больцмана, Т - абсолютная
температура газа. Так как вращательному
движению двухатомной молекулы (молекула
кислорода двухатомная) соответствует
две степени свободы, то средняя энергия
вращательного движения молекулы
кислорода выразится формулой:
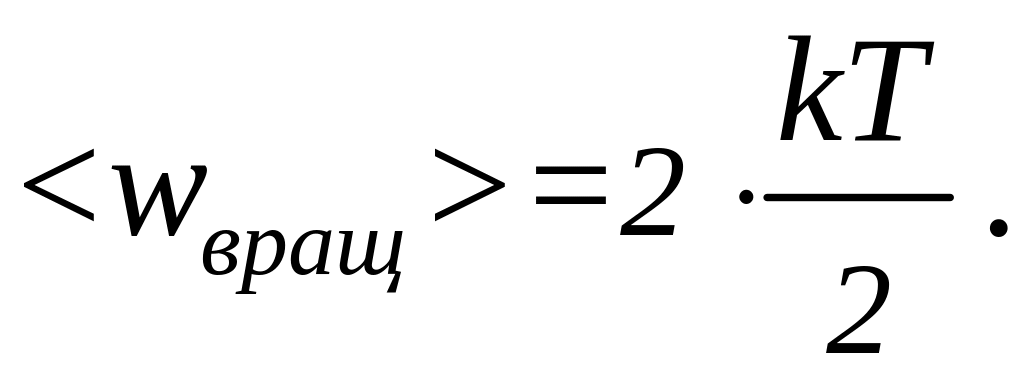 (1)
(1)
Подставив в формулу (1) значение
![]() и
T = 350 К получим
и
T = 350 К получим
![]() .
Кинетическая энергия вращательного
движения всех молекул газа определяется
равенством:
.
Кинетическая энергия вращательного
движения всех молекул газа определяется
равенством:
![]() (2)
(2)
Число всех молекул газа можно вычислить по формуле:
![]() (3)
(3)
где
![]() число Авогадро,
- количество вещества. Если учесть, что
количество вещества
число Авогадро,
- количество вещества. Если учесть, что
количество вещества
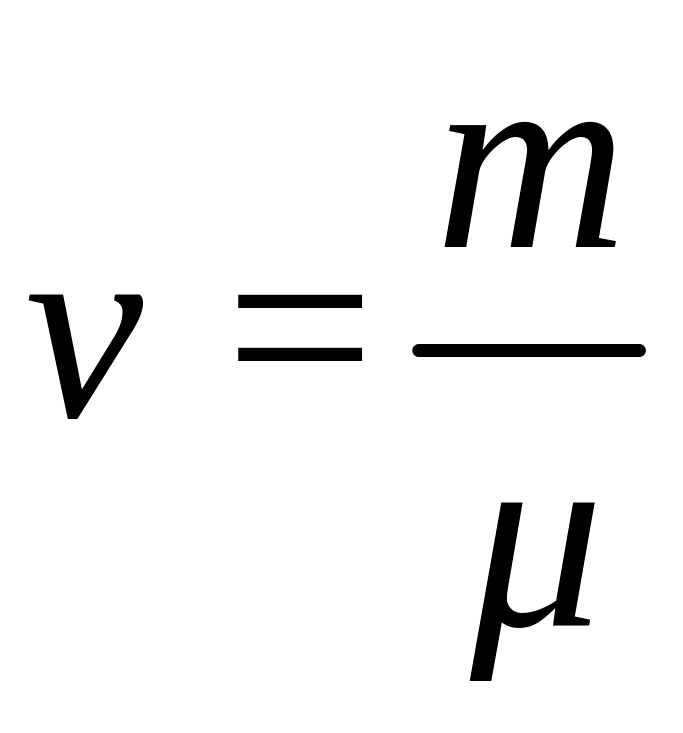 ,
где
- масса газа, μ - молярная масса газа,
то формула (3) примет вид:
,
где
- масса газа, μ - молярная масса газа,
то формула (3) примет вид:
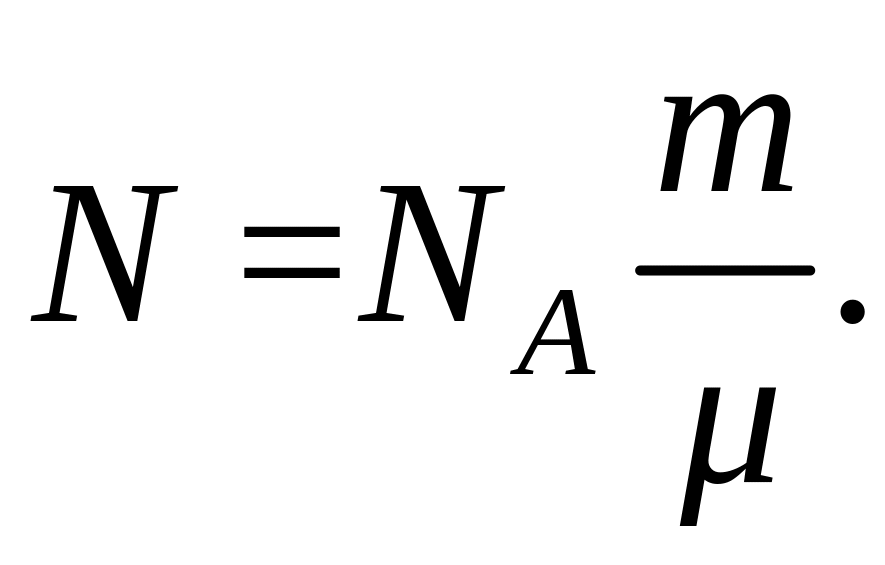
Подставив это выражение в формулу (2) получим:
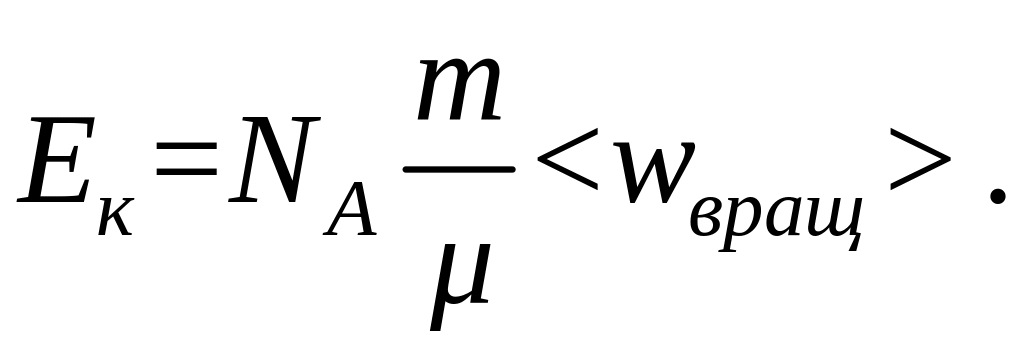 (4)
(4)
Выразим величины, входящие в эту формулу, в единицах СИ:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
Подставив эти значения в формулу (4),
найдем:
.
Подставив эти значения в формулу (4),
найдем: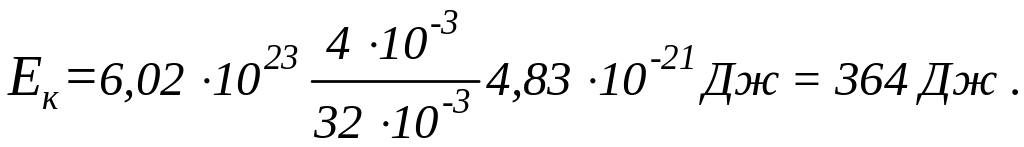
Пример 5. Вычислить удельные
теплоемкости при постоянном объеме
![]() и при постоянном давлении
и при постоянном давлении
![]() неона
и водорода, принимая эти газы за
идеальные.
неона
и водорода, принимая эти газы за
идеальные.
Решение: Удельные теплоемкости идеальных газов выражаются формулами
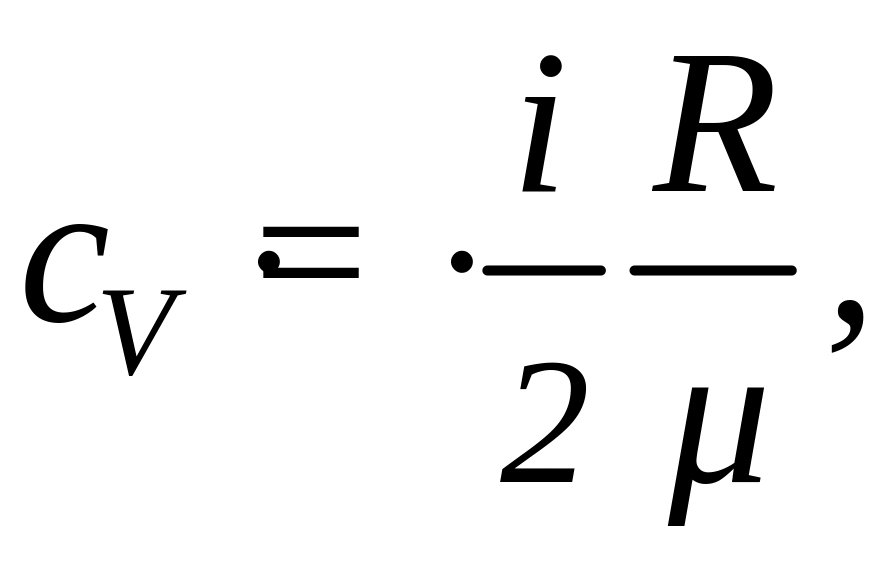 (1)
(1)
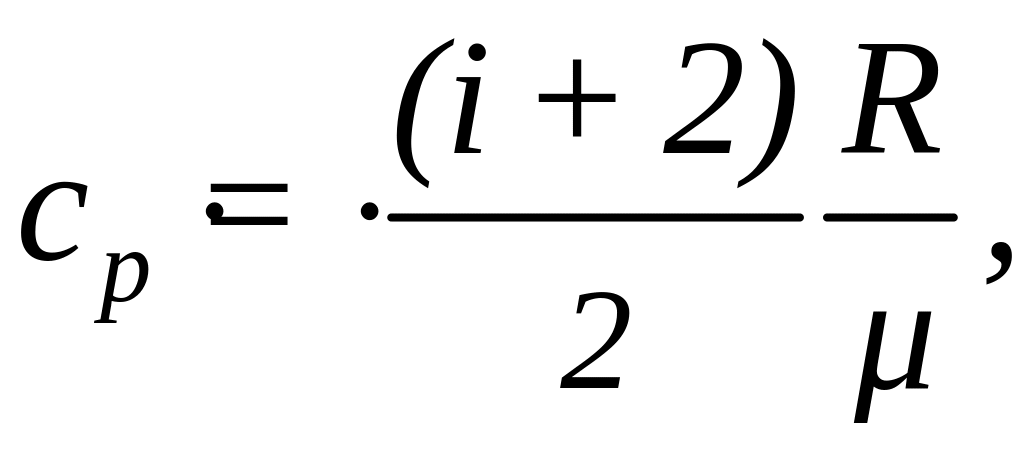 (2)
(2)
где
![]() - число степеней свободы молекул газа,
- число степеней свободы молекул газа,
![]() - молярная масса. Для неона (одноатомный
газ)
- молярная масса. Для неона (одноатомный
газ)
![]() ,
,
![]() кг/моль
(см. справочную таблицу). Вычисляя по
формулам (1) и (2), получим:
кг/моль
(см. справочную таблицу). Вычисляя по
формулам (1) и (2), получим:
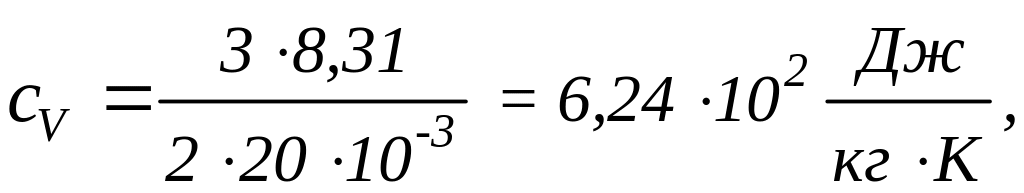
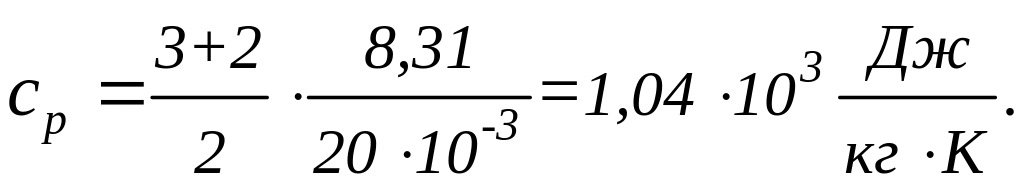
Для водорода (двухатомный газ)
![]() ,
,
![]() кг/моль. Вычисляя по тем же формулам,
получим:
кг/моль. Вычисляя по тем же формулам,
получим:
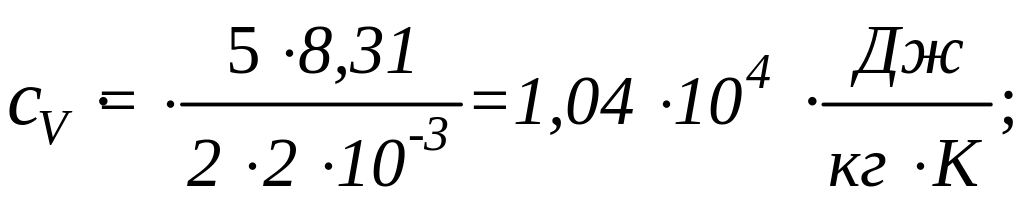
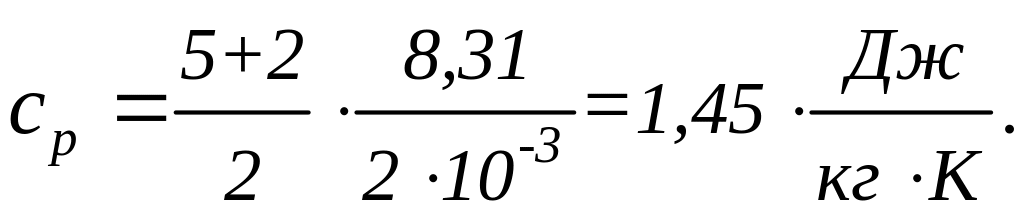
Пример 6. Вычислить удельные
теплоемкости
и
смеси неона и водорода, если массовая
доля неона
![]() = 80%, массовая доля водорода
= 80%, массовая доля водорода
![]() = 20%. Значение удельных теплоемкостей
газов взять из предыдущего примера.
= 20%. Значение удельных теплоемкостей
газов взять из предыдущего примера.
Решение: Удельную теплоемкость
смеси при постоянном объеме
найдем следующим образом. Теплоту,
необходимую для нагревания смеси на
![]() ,
выразим двумя способами.
,
выразим двумя способами.
![]()
![]() (1)
(1)
![]() (2)
(2)
где
![]() -
удельная теплоемкость неона,
-
удельная теплоемкость неона,
![]() - удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив
обе части полученного равенства на
.
получим:
- удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив
обе части полученного равенства на
.
получим:
![]()
отсюда
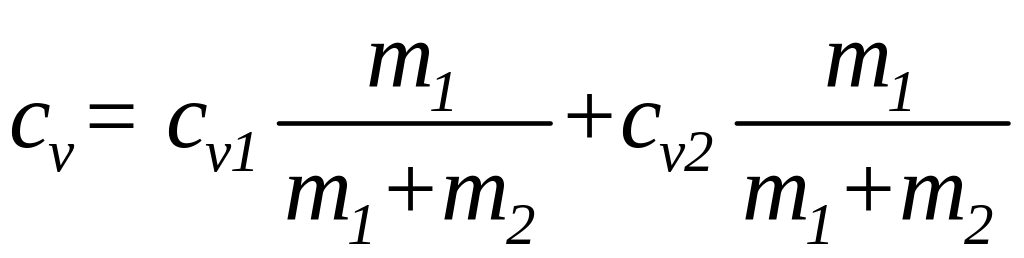 (3)
(3)
или
![]() (4)
(4)
где
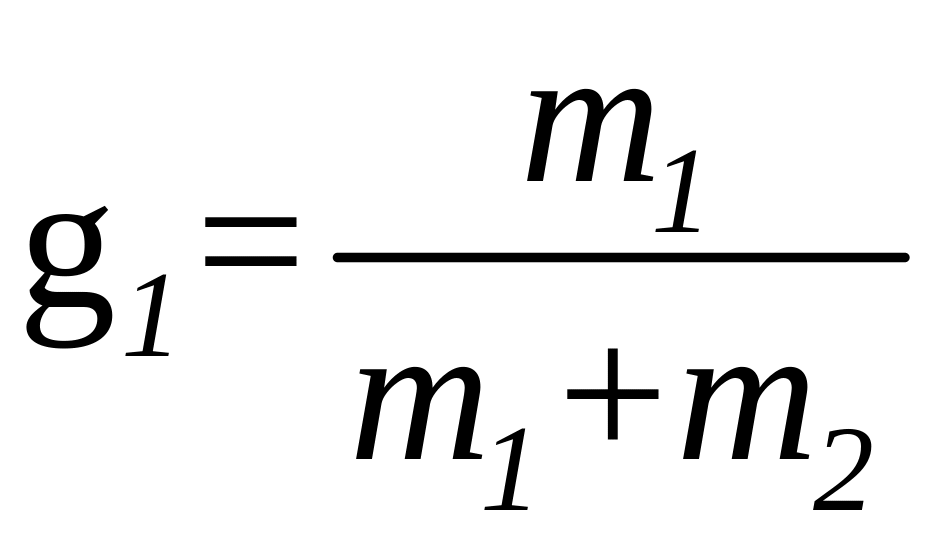 и
и
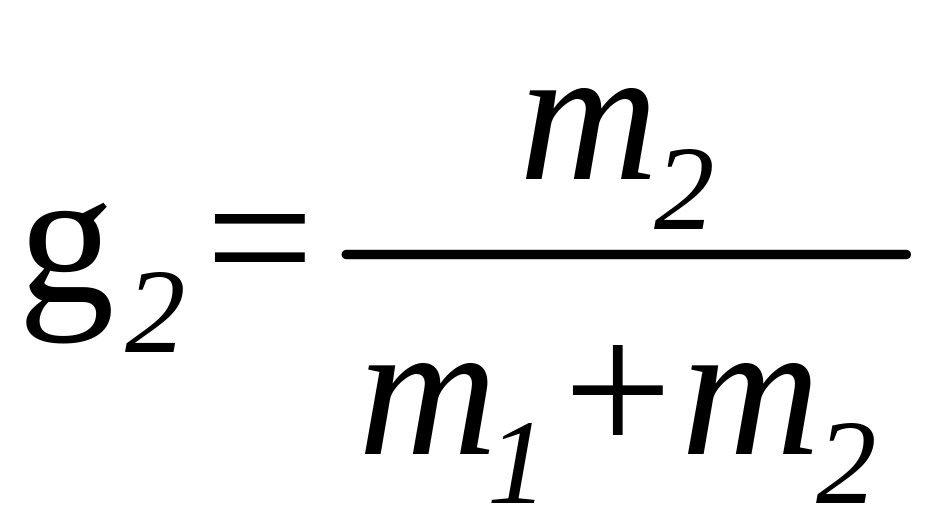 - массовые доли неона и водорода в смеси.
Подставив в формулу (4) числовые значения
величин, найдем:
- массовые доли неона и водорода в смеси.
Подставив в формулу (4) числовые значения
величин, найдем:
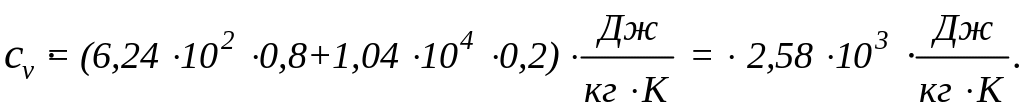
Рассуждая таким же образом, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
![]() (5)
(5)
Подставим в формулу (5) числовые значения величин:
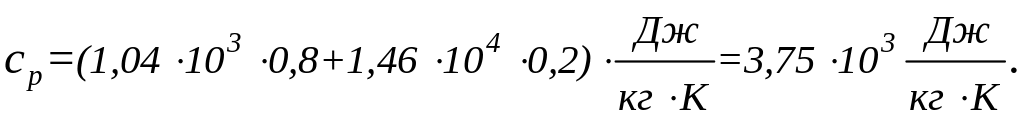
Пример 7. Кислород массой m
= 2 кг занимает объем
равный V = 1
м3 и находится под
давлением P
= 0,2 МПа. Газ был нагрет сначала при
постоянном давлении до объема V2=
3 м3, а затем при постоянном
объеме до давления Р![]() = 0,5 МПа. Найти изменение
внутренней энергии газа, совершенную
им работу А и теплоту Q
, переданную газу. Построить график
процесса.
= 0,5 МПа. Найти изменение
внутренней энергии газа, совершенную
им работу А и теплоту Q
, переданную газу. Построить график
процесса.
Решение: Изменение внутренней энергии газа выражается формулой:
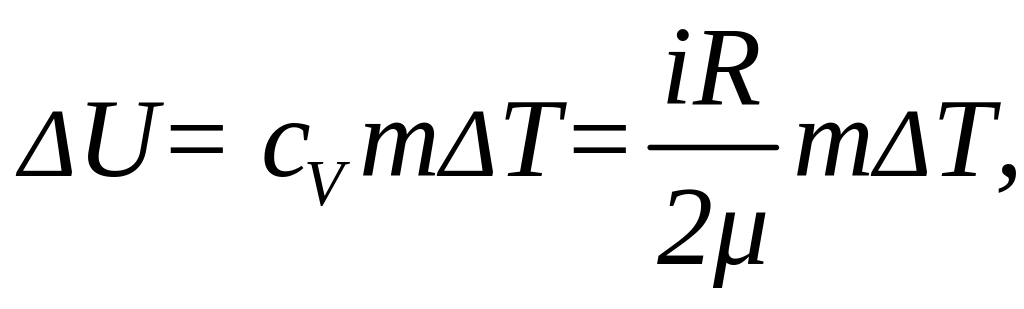 (1)
(1)
где i - число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5), μ - молярная масса. Начальную и конечную температуру газа найдем из уравнения Клапейрона-Менделеева:
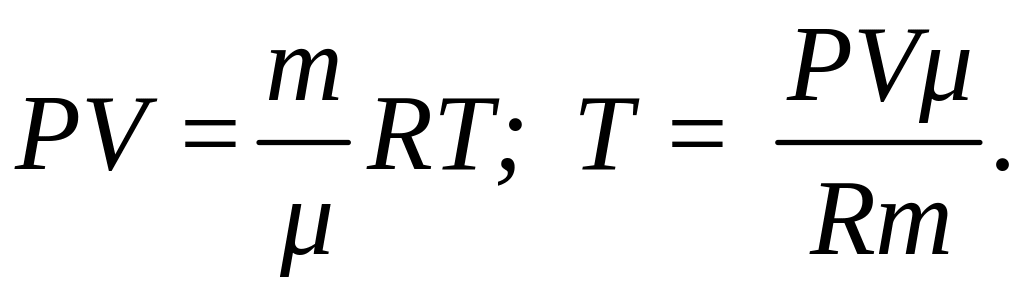 (2)
(2)
Выпишем заданные величины в единицах
системы СИ:
![]() ,
,
![]() кг/моль,
= 8,31 Дж/моль К, V
= 1 м
,
V2
= V3
= 3 м 3,
P
= P2 =
0,2 МПа = 2
кг/моль,
= 8,31 Дж/моль К, V
= 1 м
,
V2
= V3
= 3 м 3,
P
= P2 =
0,2 МПа = 2![]() 105
Па, Р
= 0,5 МПа = 5
105
Па. Подставляя эти значения
в выражение (2) и выполняя арифметические
действия, получим:
105
Па, Р
= 0,5 МПа = 5
105
Па. Подставляя эти значения
в выражение (2) и выполняя арифметические
действия, получим:
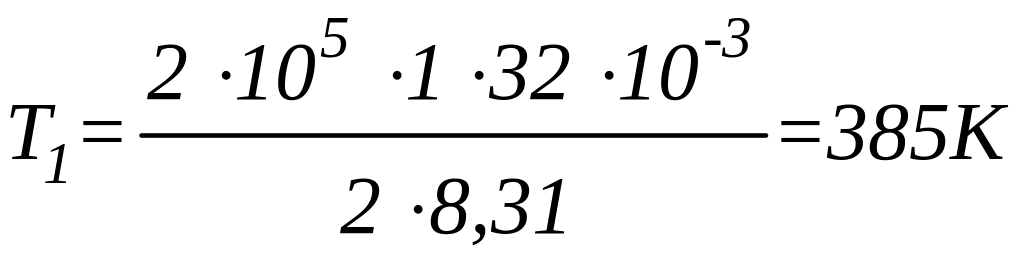 ;
;
![]() ;
;
![]() .
.
Подставляя в выражение (1) числовые значения величин, входящих в него и выполняя арифметические действия, находим:
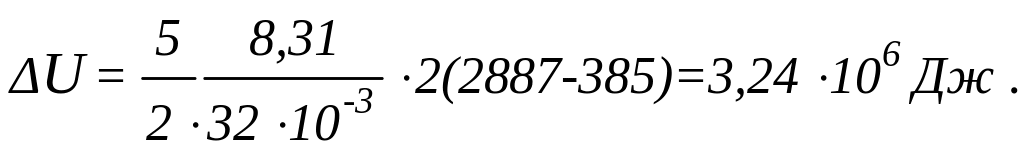
Работа расширения газа при постоянном давлении выражается формулой:
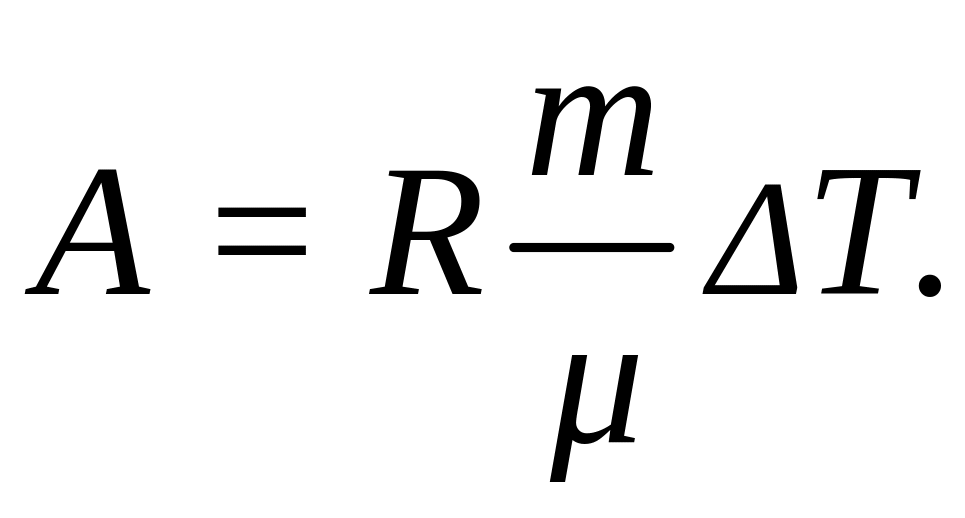
Подставим числовые значения величин, получим:
![]() .
.
Работа газа, нагреваемого при постоянном
объеме, равна нулю, т.е.
![]() .
Следовательно, полная работа, совершенная
газом, равна
.
Следовательно, полная работа, совершенная
газом, равна
![]() =
=
![]() Дж.
Дж.
Согласно первому началу термодинамики
теплота Q, переданная
газу, равна сумме изменения внутренней
энергии и работы A:
![]() ,
следовательно
,
следовательно
![]() .
.
Пример 8. Тепловая машина работает по обратному циклу Карно. Температура нагревателя T = 500 К. Определить термический КПД цикла и температуру Т2 охладителя тепловой машины, если за счет каждого килоджоуля теплоты, полученной от нагревателя, машина совершает работу А = 350 Дж.
Решение: Термический КПД тепловой машины, называемый также коэффициентом использованной теплоты, показывает, какая доля теплоты, полученной от нагревателя, превращается в механическую работу. Термический КПД выражается формулой:
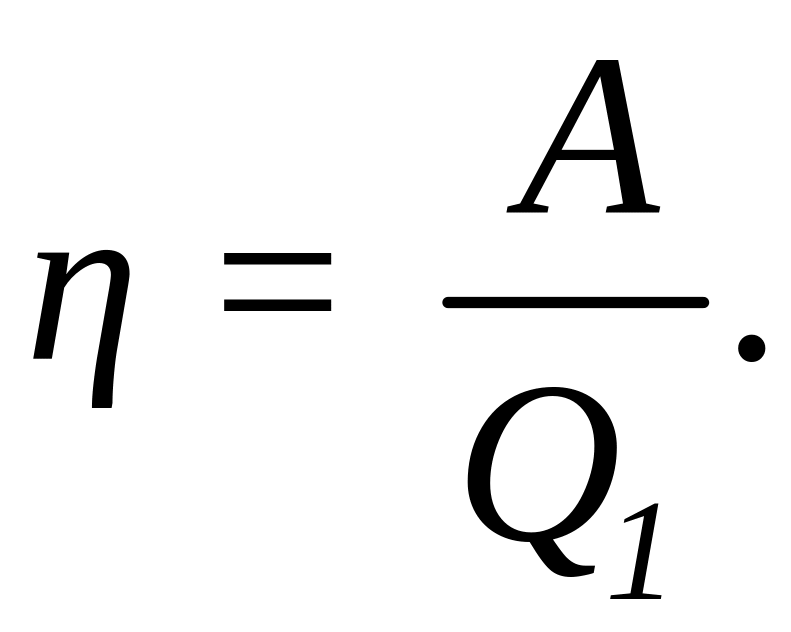
где Q - теплота, полученная от нагревателя, А - работа, совершаемая рабочим телом тепловой машины. Подставив числовые значения в эту формулу, получим
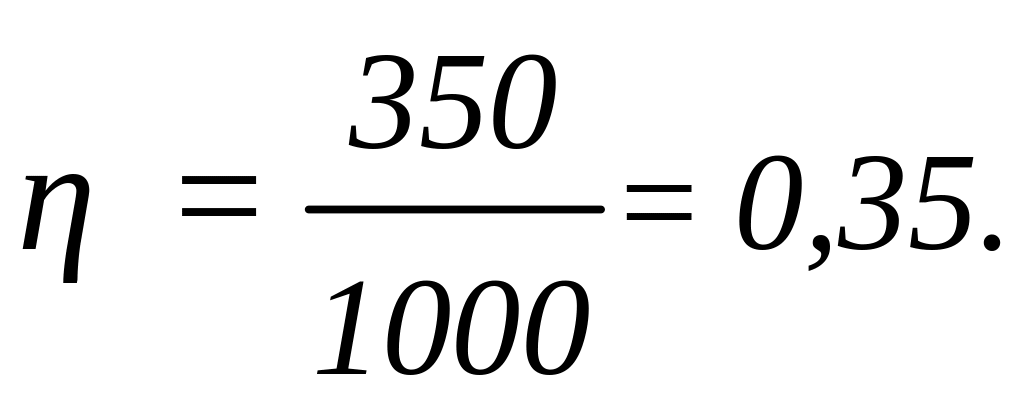
Зная КПД цикла, можно по формуле
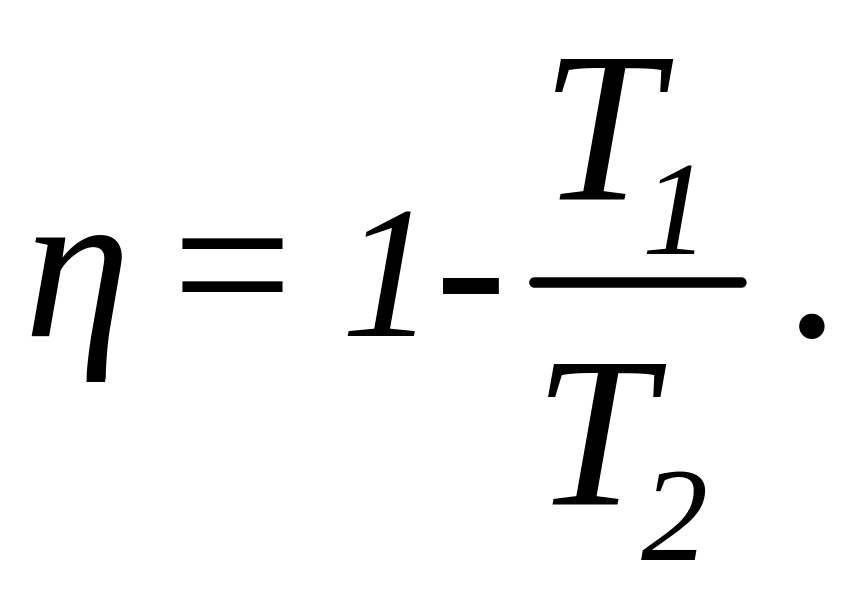 определить температуру охладителя Т2:
определить температуру охладителя Т2:
![]()
Подставив в эту формулу полученное значение КПД и температуры T нагревателя, получим:
![]()
Пример 9. Найти добавочное давление внутри мыльного пузыря диаметром d = 10 см. Какую работу нужно совершить, чтобы выдуть этот пузырь?
Решение: Пленка мыльного пузыря
имеет две сферические поверхности -
внешнюю и внутреннюю. Обе поверхности
оказывают давление на воздух, заключенный
внутри пузыря. Так как толщина пленки
чрезвычайно мала, то диаметры обеих
поверхностей практически одинаковы.
Поэтому добавочное давление, где
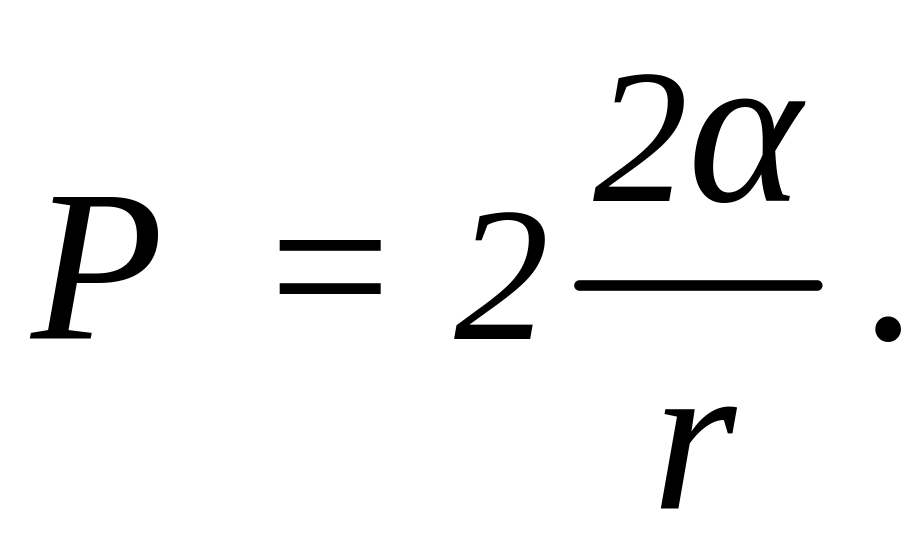 -
. где
радиус пузыря. Так как
-
. где
радиус пузыря. Так как
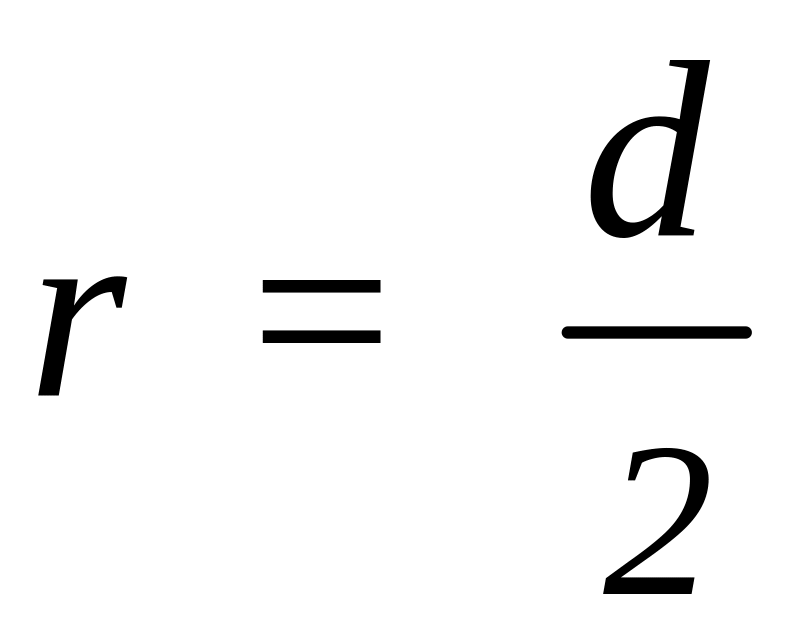 ,
то
,
то
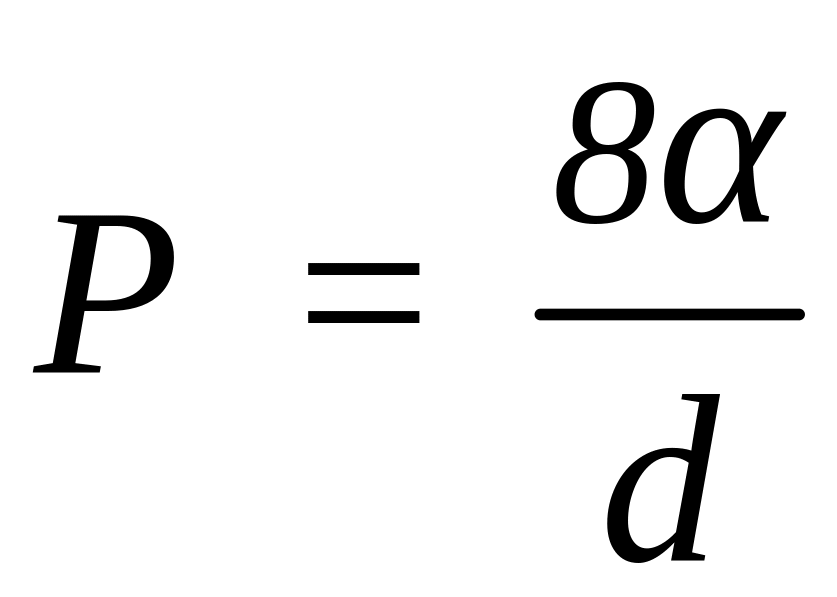 .
Коэффициент поверхностного натяжения
мыльной воды 40 мН/м (см. справочную
табл.) диаметр пузыря = 10 см
= 0,1 м.
.
Коэффициент поверхностного натяжения
мыльной воды 40 мН/м (см. справочную
табл.) диаметр пузыря = 10 см
= 0,1 м.
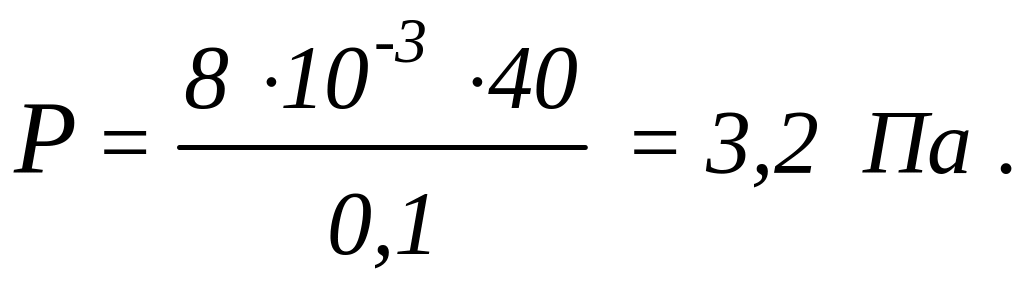
Работа,
которую нужно совершить, чтобы, растягивая
пленку, увеличить её поверхность на
![]() ,
выражается формулой
,
выражается формулой
![]()
В
данном случае
![]() - общая площадь двух сферических
поверхностей пленки, затягивающей
отверстие трубки до выдувания пузыря,
пренебрегая
,
получим
- общая площадь двух сферических
поверхностей пленки, затягивающей
отверстие трубки до выдувания пузыря,
пренебрегая
,
получим
![]()
Подставив числовые значения величин, получим:
![]() .
.
