
Лекція 3
Залежність швидкості реакції від температури
Як відомо, швидкість величезної більшості хімічних реакцій стрімко зростає із збільшенням температури. Саме тому нагрівання є дуже поширеним прийомом, як у хімічній практиці, так і в інших галузях: техніці, кулінарії, побуті і фармації зокрема. З цим явищем ми стикаємось і в біології: при зниженні температури усі процеси в деяких організмах суттєво сповільнюються і вони переходять у стан анабіозу.
За законом діючих мас:
![]() (4)
(4)
Отже, вплив температури може здійснюватись через зміну концентрації, через порядок реакції і через зміну константи швидкості реакції. З досвіду відомо, що основний вплив температура вчиняє на константу швидкості. Тому, кажучи про вплив температури на швидкість,мають на увазі зміну константи швидкості.
Для
багатьох хімічних реакцій, що протікають
у інтервалі 0-100 ºС, справедливе емпіричне
правило Вант-Гоффа: при підвищенні
температури на 10 ºС (10 К) швидкість
реакції
зростає у 2-4 рази. Відношення швидкості
реакції при температурі Т до швидкості
при температурі Т+10 називають температурним
коефіцієнтом Вант-Гоффа
![]() .
.
 (31)
(31)
У випадку, коли зміна температури не рівна 10 ºС, зручно користуватися рівнянням:
 (32)
(32)
ПравилоВан-Гоффа наближене і не враховує залежність температурного коефіцієнта від температури, оскільки, , при зростанні температури, прямує до одиниці.
Голландський учений Арреніус експериментально встановив більш точну залежність константи швидкості від температури:
![]() (33)
(33)
В сучасному вигляді рівняння Арреніуса (32) представляють:
![]() ,
(34)
,
(34)
або:
![]() (35)
(35)
Або у диференційній формі:
![]() (36)
(36)
Коефіцієнт
рівняння k0
- передекспоненційний
множник,
має розмірність константи швидкості
відповідного порядку. Для елементарних
реакцій k0
можна розрахувати теоретично використовуючи
молекулярно-кінетичну теорію та
статистичну термодинаміку. Цей коефіцієнт
дещо залежить від температури, але цією
залежністю можна знехтувати порівняно
з
![]()
Константа рівнянь (34-36) E має розмірність Дж/моль і носить назву енергія активації реакції. Хоча теоретичне обґрунтування рівняння Арреніуса виконане лише для елементарних реакцій, досвід показує, що, більшість складних реакцій також підпорядковуються даному рівнянню. У цьому випадку, енергія активації – це мінімальна надлишкова, у порівнянні з середнім рівнем,кількість енергії, яку треба надати 1 молю речовини, щоб вона вступила ухімічне перетворення.
В
часи Арреніуса енергія
активації
розглядалась як суто емпірична константа,
однак зараз, для елементарних реакцій,
її можна оцінити з допомогою квантової
хімії. Емпіричне рівняння (35), у наш час,
також можна вивести для елементарних
реакцій на основі теорії перехідного
стану (активованого комплексу). Згідно
з цією теорією енергія
активації
приблизно дорівнює перевищенню середньої
енергії активованого комплексу над
середньою енергією вихідних речовин.
Для реакції А↔В
, енергії активації прямої і зворотної
реакцій пов’язані співвідношенням
![]() .
Відповідно, для екзотермічної реакції
.
Відповідно, для екзотермічної реакції
![]() ,
,
![]() ;
для ендотермічної
;
для ендотермічної
![]() і
і
![]() .
.
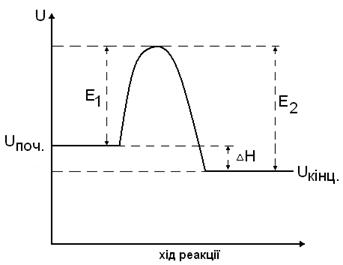
Рис.14.Зміна енергії під час екзотермічної реакції

Рис.15.Зміна енергії під час ендотермічної реакції
Для знаходження енергії активації реакції необхідно експериментально визначити константишвидкості хоча б при двох температурах:
 (а),
(а),
 (б)
(б)
Розділимо (б) на(а) і дістанемо:
 (37)
(37)
Точніше
енергію активації знаходять графічно,
побудувавши за експериментальними
даними залежність
![]() .
З рівняння (34) видно, що кутовий коефіцієнт
отриманої прямої
.
З рівняння (34) видно, що кутовий коефіцієнт
отриманої прямої
![]() ,
а відрізок, що відсікається на осі
ординат – дорівнює k0
.
,
а відрізок, що відсікається на осі
ординат – дорівнює k0
.

Рис.16.Графічне визначення енергії активації та передекспоненційного множника
Величина енергії активацій реакцій, які підпорядковуються, правилу Вант-Гоффа і протікають при температурі ≈300К лежить у межах 50-100 кДж/моль.
Існують реакції для яких рівняння Арреніуса та правило Вант-Гоффа не підтверджуються. Це реакції з нетермічним характером активації, гетерогенні реакції, що протікають у дифузійній області, а також деякі специфічні реакції, як, наприклад, реакція окиснення оксиду азоту: 2NO + O2 =2NO2 , для якої характерне зменшення швидкості при збільшення температури.
