
2.4. Молекулярно-кинетическая интерпретация явлений переноса
Мы рассмотрим явления переноса в газах с молекулярно-кинетической точки зрения. Соответствующие расчеты будут иметь оценочный характер.
Оценочный подход — это то, с чего обычно начинается создание теории. Главное достоинство такого подхода состоит в простоте и акценте на физической стороне явления, не заслоненной громоздкими вычислениями и преобразованиями.
Будем исходить из предельно упрощенной модели:
- ввиду полной хаотичности теплового движения молекул будем считать, что молекулы движутся по трем направлениям X, Y и Z, так что на каждое направление в одну сторону плотность потока молекул составляет
![]() ,
,
Где n – концентрация
молекул. Эти
потоки и являются переносчиками
определенных физических величин G.
Плотность
потока величины G
будем
обозначать![]() .
.
- будем считать,
что через интересующую нас площадку S
молекулы будут переносить то значение
величины G,
которое они
имели на расстоянии
![]() от
площадки S.
Т. е. будем предполагать, что последнее
соударение молекулы испытывают на этом
расстоянии от S.
от
площадки S.
Т. е. будем предполагать, что последнее
соударение молекулы испытывают на этом
расстоянии от S.
Начнем с вывода общего уравнения переноса, не зависящего от времени.
Общее уравнение переноса.
Пусть величина G характеризует определенное молекулярное свойство, отнесенное к одной молекуле. Это может быть энергия, импульс, электрический заряд и др.
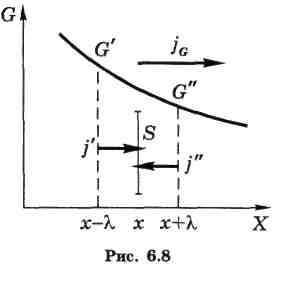 Ясно,
что при наличии градиента величины G
должен
возникнуть поток в сторону ее уменьшения.
Ясно,
что при наличии градиента величины G
должен
возникнуть поток в сторону ее уменьшения.
Пусть величина G меняется только в направлении оси X, например, так, как показано на рис. 6.8.
Площадку S будут пронизывать молекулы, движущиеся во встречных направлениях,
их плотности потоков обозначим j' и j".
Причем — это существенно — они должны быть равны друг другу (j' = j") чтобы не возникало газодинамических потоков и чтобы все процессы сводились только к переносу величины G. Тогда для результирующей плотности потока величины G можно (см. рис. 6.8) записать:
![]() (6.19)
(6.19)
Благодаря малости разность значений G"-G' представим в виде
![]() (6.20)
(6.20)
С учетом этой формулы выражение (6.19) запишем так:
![]() (6.21)
(6.21)
Это и есть общее уравнение переноса для любой величины G. Здесь п0 — концентрация молекул,
![]() — их средняя
тепловая скорость.
— их средняя
тепловая скорость.
Значения этих величин берутся в сечении S.
Применим это уравнение к трем наиболее интересным явлениям переноса, связанным с диффузией, вязкостью и теплопроводностью.
Диффузия. Ограничимся рассмотрением самодиффузии, т. е. процессом перемешивания (взаимопроникновения) молекул одного сорта.
 Макроскопически
самодиффузию наблюдать нельзя: из-за
тождественности молекул она не может
проявляться ни в одном явлении. Для
наблюдения этого процесса часть молекул
газа надо как-то «пометить». Практически
это можно сделать с помощью так называемых
«меченых» атомов: смесь газов берут из
двух изотопов одного и того же элемента,
один из которых радиоактивен. Тогда
процесс диффузии можно наблюдать,
регистрируя радиоактивное излучение
радиоизотопа. Можно также взять смесь
двух различных газов, молекулы которых
почти одинаковы по массе и размерам
(такие, например, как N2
и СО). В этом случае у обеих компонент
газа будут одинаковы как средние
скорости, так и длины свободного пробега,
т. е.
и
.
Макроскопически
самодиффузию наблюдать нельзя: из-за
тождественности молекул она не может
проявляться ни в одном явлении. Для
наблюдения этого процесса часть молекул
газа надо как-то «пометить». Практически
это можно сделать с помощью так называемых
«меченых» атомов: смесь газов берут из
двух изотопов одного и того же элемента,
один из которых радиоактивен. Тогда
процесс диффузии можно наблюдать,
регистрируя радиоактивное излучение
радиоизотопа. Можно также взять смесь
двух различных газов, молекулы которых
почти одинаковы по массе и размерам
(такие, например, как N2
и СО). В этом случае у обеих компонент
газа будут одинаковы как средние
скорости, так и длины свободного пробега,
т. е.
и
.
Вследствие теплового движения молекул будет происходить процесс выравнивания концентраций, сопровождающийся переносом массы каждой из компонент в направлении убывания ее концентрации. Этот процесс носит название диффузии.
Диффузия наблюдается также в жидких и твердых телах.
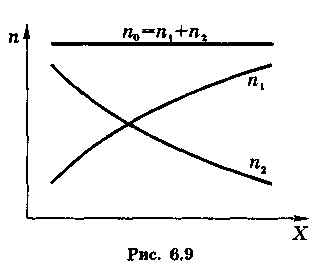
Чтобы отсутствовали газокинетические потоки и перемешивание молекул происходило только за счет диффузии, необходимо, чтобы суммарная концентрация по обеих компонент смеси не зависела от координаты в направлении оси X, вдоль которой происходит этот процесс (рис. 6.9).
Пусть концентрация молекул 1-го сорта зависит от координаты х как п1(х).
Учитывая, что
величина G
в уравнении
(6.21) есть характеристика переносимого
количества, отнесенного к одной
молекуле,
имеем
![]() ,
где n0
—равновесная концентрация (см. рис.
6.9). Тогда уравнение (6.21) в данном
случае примет вид
,
где n0
—равновесная концентрация (см. рис.
6.9). Тогда уравнение (6.21) в данном
случае примет вид
![]() (6.22)
(6.22)
Сравнив это выражение с эмпирической формулой (6.9), находим, что коэффициент самодиффузии
![]() (6.23)
(6.23)
Рассуждения, приведшие нас к формуле (6.22), в равной мере справедливы и для другой компоненты смеси. Значит, коэффициент D одинаков для обеих компонент.
Более строгий расчет приводит к такой же формуле для D, но с несколько большим числовым коэффициентом в 1,2+1,5 раза для разных газов.
Единицей измерения коэффициента D является м2/с.
В отличие от η и κ коэффициент диффузии оказывается обратно пропорциональным числу молекул в единице объема, а следовательно, и давлению р:
![]()
Зависимость от температуры у D такая же, как у η и æ.
При нормальных условиях коэффициент D для кислорода и азота в воpдухе имеет порядок 10-5 м2/с/
 Вязкость
(внутреннее трение).
Это явление
возникает в тех случаях, когда на
хаотическое тепловое движение молекул
накладывается упорядоченное
движение.
Вязкость
(внутреннее трение).
Это явление
возникает в тех случаях, когда на
хаотическое тепловое движение молекул
накладывается упорядоченное
движение.
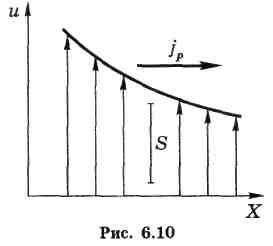
Пусть скорость и упорядоченного движения зависит только от координаты х, как показано на рис. 6.10.
В этом случае через единичную площадку S будет происходить перенос импульса р = ти, где т — масса молекулы.
Это значит, что в данном случае величина G = р и согласно уравнению (6.21) мы находим, что плотность потока импульса
![]() (6.24)
(6.24)
Где
![]() —
плотность газа.
—
плотность газа.
Сопоставив это
уравнение с эмпирической формулой
(6.11), находим выражение для вязкости:![]()
![]() (6.25)
(6.25)
Более точный расчет дает несколько большее значение для числового коэффициента: не 1/3, а 0,49.
Единицей вязкости в СИ является паскаль-секунда (Па-с), а в системе СГС — пуаз (П).
Связь между ними: 1 Па-с = 10 П.
При нормальных
условиях вязкость газов
![]()
Мы получили, что η не зависит
от числа молекул в единице объема,
следовательно, и от давления (р = nkT),
Этот результат имеет следующее объяснение.
С понижением давления уменьшается n, т. е. число молекул, участвующих в переносе импульса.
Одновременно растет λ, а значит, и различие в импульсах, переносимых одной молекулой в противоположных направлениях.
В итоге получается, что суммарный импульс, переносимый молекулами при данном градиенте скорости du/dz, не зависит от давления.
Это справедливо лишь до тех пор, пока λ остается малой по сравнению с размерами зазора, в котором течет газ (например, по сравнению с диаметром трубы). По мере того как перестает выполняться это условие:
- вязкость начинает все больше зависеть от давления, уменьшаясь с его понижением.
- Когда средняя длина пробега становится сравнимой с размерами зазора, в котором течет газ, пробег молекул будет определяться величиной зазора и λ перестает зависеть от давления.
- Число же молекул в единице объема при уменьшении давления продолжает убывать, вследствие чего уменьшается и η.
Очевидно, коэффициент вязкости
должен расти с температурой пропорционально
![]() .
Опыт дает, что η возрастает несколько
быстрее, чем
.
Причиной этого служит зависимость
средней длины свободного пробега от
температуры.
.
Опыт дает, что η возрастает несколько
быстрее, чем
.
Причиной этого служит зависимость
средней длины свободного пробега от
температуры.
Теплопроводность. В этом явлении величиной G в (6.21) является средняя энергия теплового движения приходящаяся на одну молекулу.
Из теоремы о
равнораспределении энергии по степеням
свободы имеем![]() ,
и тогда
плотность потока тепла
,
и тогда
плотность потока тепла
![]() (6.26)
(6.26)
Для упрощения этой
формулы введем удельную теплоемкость
![]() .
Для этого
обратим внимание на то, что (i/2)k
— это
теплоемкость при постоянном объеме,
рассчитанная на одну молекулу.
.
Для этого
обратим внимание на то, что (i/2)k
— это
теплоемкость при постоянном объеме,
рассчитанная на одну молекулу.
Произведение
данной величины на концентрацию n0
дает теплоемкость единицы массы
умноженную
на плотность газа
![]() .
.
Таким образом,
учитывая, что![]() ,
перепишем
(6.26) в виде
,
перепишем
(6.26) в виде
![]()
Из сравнения этого выражения с формулой (6.12) видим, что теплопроводность
æ=![]() (6.28)
(6.28)
Более точные вычисления числового коэффициента в (6.28) представляют большие трудности, но полученные результаты оказываются того же порядка, что и 1/3.
æ— коэффициент пропорциональности, зависящий от свойств среды и называемый коэффициентом теплопроводности.
Единицей теплопроводности является Вт/(м К).
Выясним зависимость æот
величин, характеризующих молекулу,
параметров газа.
Поскольку æ ~![]() , подставим
, подставим
![]()
В результате получается, что æ
![]()
Эта зависимость отличается от зависимости
для η тем, что κ обратно пропорционален
![]() ,
в то время как η прямо пропорционален
.
,
в то время как η прямо пропорционален
.
Кроме того, æ зависит
от числа и характера степеней свободы молекулы (от числа i).
Зависимость от давления и температуры у κ такая же, как и у η.
Следовательно, коэффициент теплопроводности не зависит
от давления (до тех пор, пока λ не становится того же порядка, что и линейный размер сосуда, вдоль которого передается тепло)
и возрастает с температурой несколько быстрее, чем .
При заданной
концентрации n0
теплопроводность зависит в основном
от средней скорости
.
Из-за этого легкие газы обладают
значительно большей теплопроводностью,
чем тяжелые, поскольку
![]() Например, при нормальных условиях
кислород имеет теплопроводность 0,024
Вт/(м-К), а водород — 0,176 Вт/(м-К).
Например, при нормальных условиях
кислород имеет теплопроводность 0,024
Вт/(м-К), а водород — 0,176 Вт/(м-К).
Анализ коэффициентов переноса. Прежде всего выпишем для удобства сопоставления и анализа все три коэффициента рассмотренных явлений переноса:
(6.29)
æ=
1) Определив по эмпирическим формулам коэффициенты D, и æ, мы имеем возможность с помощью формул (6.29) вычислить и диаметр d молекул. При этом следует иметь в виду, что полученные значения заметно зависят от того, на основании какого коэффициента их вычисляют (поэтому в таблицах это оговаривается)
2) Все три
коэффициента D,
и æ,
с ростом температуры Т увеличиваются,
так как
![]() .
.
3) Поскольку
![]() ,
а
,
а
![]() ,
то как вязкость
,
так и теплопроводность æ
не зависят от концентрации, а значит и
от давления (при неизменной температуре).
,
то как вязкость
,
так и теплопроводность æ
не зависят от концентрации, а значит и
от давления (при неизменной температуре).
