- •Спектроскопические метoды анализа
- •1.1 Молекулярная спектроскопия
- •1. Молекулярная спектроскопия
- •Основной закон светопоглощения
- •Методы определения содержания определяемого вещества
- •Общие указания по выполнению практических работ по фотометрии
- •Порядок работы на фотоэлектроколориметре кфк-2.
- •Подготовка к работе.
- •Измерение.
- •Работа 1. Исследование колориметрической реакции.
- •Работа 2. Определение никеля с диметилглиоксимом в присутствии окислителей.
- •Работа 4. Определение меди в виде аммиаката методом дифференциальной фотометрии.
- •Атомно-абсорбционная спектроскопия
- •Работа 5. Определение железа в природной воде
- •Потенциометрия и потенциометрическое титрование
- •Характеристики ионоселективных электродов с твердой мембраной.
- •Работа 1. Определение рН .
- •Работа 2. Определение соляной или уксусной кислоты.
- •Работа 4. Определение содержания хлорид- и иодид- ионов в растворе при совместном присутствии.
- •Работа 5. Определение железа
- •Хроматографические методы.
- •Ионообменная хроматография
- •3.1.2. Определение физических свойств ионитов.
- •Определение обменной емкости ионита.
- •Определение статической обменной емкости (сое) катионита.
- •Выполнение работы
- •3.1.4. Определение общей концентрации электролита.
- •3.1.5. Определение меди и цинка при совместном присутствии
Работа 4. Определение меди в виде аммиаката методом дифференциальной фотометрии.
Метод основан на образовании комплексного соединения ионов меди(II) с аммиаком, обладающего интенсивной сине-фиолетовой окраской. Окраска аммиаката меди обусловлена d→d* переходами вследствие расщепления основного электронного состояния ионов меди в поле лигандов.
Процесс взаимодействия ионов меди с аммиаком носит ступенчатый характер:
Cu2+ + NH3 ↔ [Cu(NH3)]2+;
Cu2+ + 2 NH3 ↔ [Cu(NH3)2]2+;
Cu2+ + 3 NH3 ↔ [Cu(NH3)3]2+;
Cu2+ + 4 NH3 ↔ [Cu(NH3)4]2+.
Так как устойчивость образующихся комплексов различается мало (lg β1=3.99; lg β2=7.33; lg β3=10.61; lg β4=12.03), то в растворе будет находиться смесь нескольких аммиакатов меди, количественное соотношение которых зависит от концентрации аммиака, присутствующего в растворе, что иллюстрируется данными диаграммы:
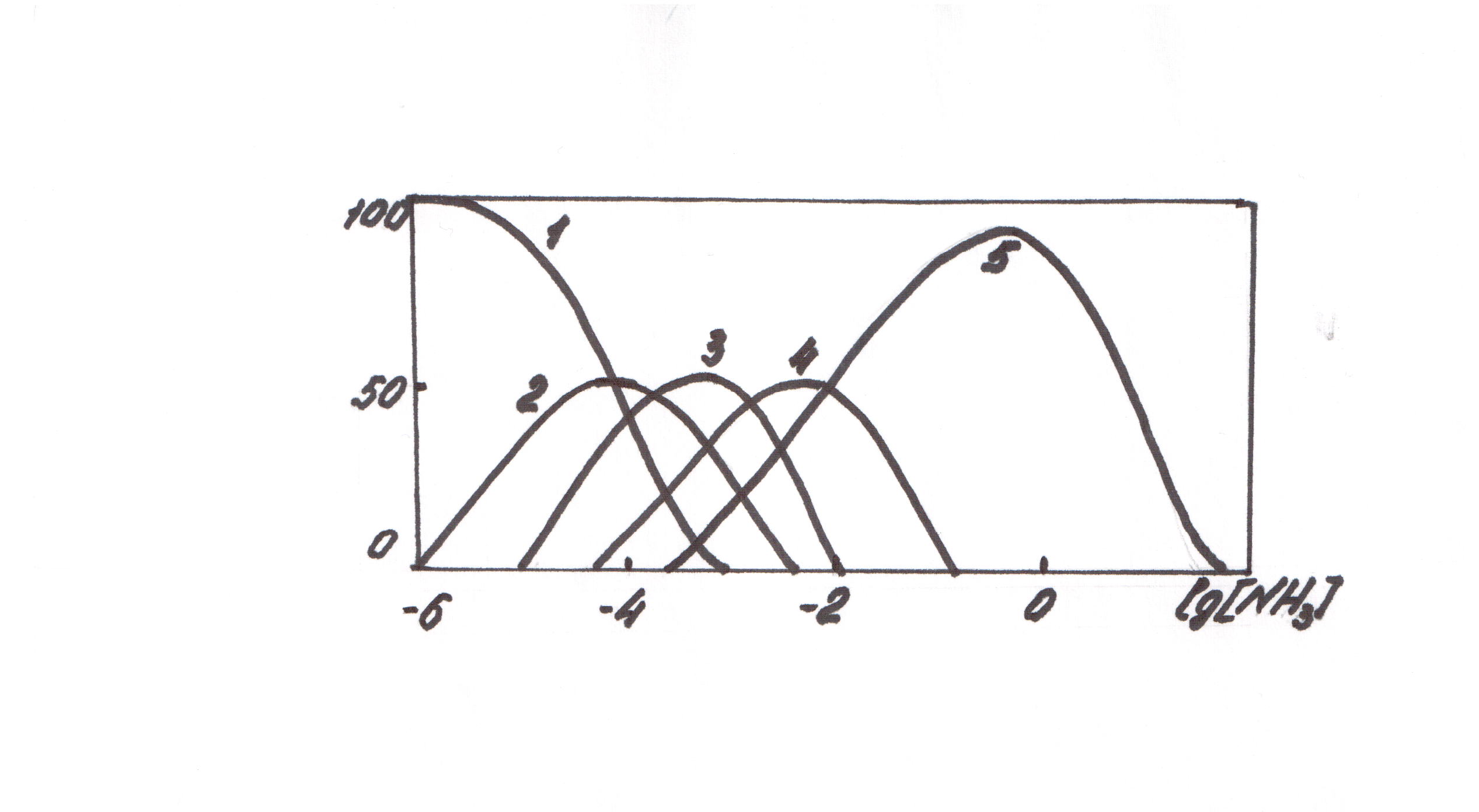
Для аналитических целей необходимо выбрать такую концентрацию аммиака, при которой в растворе будет преобладать один из комплексов, наиболее эффективно это возможно при lg [NH3] =1. Молярный коэффициент светопоглощения тетрааммиаката меди при λ=640 нм равен 1∙102. Низкое значение ε позволяет определять достаточно высокие концентрации ионов меди. Для повышения воспроизводимости определения используют метод дифференциальной фотометрии, когда раствор сравнения содержит представляет собой раствор, содержащий ионы меди в виде аммиаката, точно известной концентрации.
Определению меди в виде аммиачного комплекса мешают ионы металлов, образующие окрашенные комплексы аналогичного типа, например, кобальт и никель, или малорастворимые гидроксиды железа, свинца и алюминия. Для устранения мешающего действия этих элементов применяют маскирующие комплексообразователи.
Приборы и реактивы:
фотоэлектроколориметр КФК-2;
рабочий раствор соли меди, содержащий 1 мг/мл Cu2+; для приготовления рабочего раствора навеску 3.931 г CuSO4 ∙ 5H2O растворяют в 25 мл 2м раствора H2SO4 , доводят объем раствора до 1.00 л дистиллированной водой;
аммиак, 10%-ный раствор.
Приготовление стандартных растворов.
Готовят шесть стандартных растворов, содержащих 2.5; 5.0; 7.5; 10.0; 12.5;
15.0 мг меди в 50.0 мл. Для этого в мерные колбы вместимостью 50.0 мл переносят рабочий раствор соли меди, добавляют в каждую колбу 10.0 мл 10% -ного раствора аммиака и доводят объем каждого раствора до 50.0 мл дистиллированной водой. Через 10 минут приступают к измерению оптической плотности.
Выполнение работы.
Выбор светофильтра. Раствор, имеющий окраску средней интенсивности, фотометрируют относительно воды со всеми светофильтрами поочередно, записывая результаты в таблицу:
-
λ, нм
А
По результатам измерений строят график: А=f(λ). Для дальнейшей работы выбирают светофильтр, соответствующий наибольшему значения светопоглощения исследуемого раствора.
Посторенние градировочного графика. С выбранным светофильтром поочередно фотометрируют стандартные растворы относительно раствора, содержащего 5.0 мг меди. Если содержание меди в фотометрируемом растворе меньше, чем в растворе сравнения, применяют обратный порядок измерений: фотометрируемый раствор условно принимают за раствор сравнения, устанавливают по нему оптический ноль и по отношению к нему измеряют светопоглощение исследуемого раствора. Найденное значение поглощения берут со знаком «минус». Сочетание прямого (Со>Сх) и обратного (Со<Сх) порядков измерений в дифференциальном методе называют двусторонним дифференцированием.
Определение содержания меди(II) в растворе. К анализируемому раствору, содержащему соль меди (II), приливают 10.0 мл 10%-ного раствора аммиака и доводят объем раствора до 50.0 мл дистиллированной водой. Приготовленный раствор через 10.0 мин фотометрируют с выбранным светофильтром относительно выбранного раствора сравнения, содержащего 5.0 мг меди, используя при необходимости приемы двустороннего дифференцирования. Пользуясь градуировочным графиком, находят содержание меди в анализируемом растворе.