
- •Спектроскопические метoды анализа
- •1.1 Молекулярная спектроскопия
- •1. Молекулярная спектроскопия
- •Основной закон светопоглощения
- •Методы определения содержания определяемого вещества
- •Общие указания по выполнению практических работ по фотометрии
- •Порядок работы на фотоэлектроколориметре кфк-2.
- •Подготовка к работе.
- •Измерение.
- •Работа 1. Исследование колориметрической реакции.
- •Работа 2. Определение никеля с диметилглиоксимом в присутствии окислителей.
- •Работа 4. Определение меди в виде аммиаката методом дифференциальной фотометрии.
- •Атомно-абсорбционная спектроскопия
- •Работа 5. Определение железа в природной воде
- •Потенциометрия и потенциометрическое титрование
- •Характеристики ионоселективных электродов с твердой мембраной.
- •Работа 1. Определение рН .
- •Работа 2. Определение соляной или уксусной кислоты.
- •Работа 4. Определение содержания хлорид- и иодид- ионов в растворе при совместном присутствии.
- •Работа 5. Определение железа
- •Хроматографические методы.
- •Ионообменная хроматография
- •3.1.2. Определение физических свойств ионитов.
- •Определение обменной емкости ионита.
- •Определение статической обменной емкости (сое) катионита.
- •Выполнение работы
- •3.1.4. Определение общей концентрации электролита.
- •3.1.5. Определение меди и цинка при совместном присутствии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ПРАКТИКУМУ
ПО ФИЗИКО-ХИМИЧЕСКИМ МЕТОДАМ АНАЛИЗА
ДЛЯ СТУДЕНТОВ 2 КУРСА
СПЕЦИАЛЬНОСТИ «ХИМИЯ»
С О Д Е Р Ж А Н И Е
Спектроскопические метoды анализа
1.1 Молекулярная спектроскопия
Порядок работы на фотоэлектроколориметре КФК-2.
Работа 1. Изучение колориметрической реакции.
Работа 2.Определение никеля (II) с диметилглиоксимом в присутствии окислителя методом градировочного графика.
Работа 3.Определение железа (III) c cульфосалициловой кислотой методом добавок.
Работа 4.Определение меди (II) дифференциальным методом.
1.2 АТОМНАЯ СПЕКТРОСКОПИЯ
1.2.1. Работа 5.Определение железа в водопроводной воде.
2.ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
2.1 ПОТЕНЦИОМЕТРИЯ
2.1.1. Порядок работы на приборах
2.1.2.Работа 6. Определение соляной кислоты
2.1.3. Определение смеси соляной и уксусной кислот
2.1.4. Определение смеси бромид– и иодид–ионов
2.1.5. Определение железа (II).
2.2. Электрогравиметрия
2.2.1. Определение меди (II) методом внутреннего электролиза.
2.3. Экстракция
2.3.1. Экстракционные реакции
2.4. Хроматография
2.4.1. Определение физических свойств ионита.
2.4.2. Определение обменной емкости ионита.
2.4.3. Определение общей концентрации электролита.
2.4.4. Определение меди и цинка при совместном присутствии.
1. Молекулярная спектроскопия
Фотометрический метод количественного определения основывается на способности определяемого вещества в оптически активной форме селективно поглощать электромагнитное излучение видимого участка спектра (400-780 нм).
Общая схема фотометрического определения заключается в следующих стадиях:
1. Подготовка пробы и переведение вещества в раствор.
2. Получение окрашенной аналитической формы определяемого вещества в результате проведения реакции при оптимальных условиях, обеспечивающих максимальную избирательность и чувствительность.
3. Измерение светопоглощения раствора аналитической формы (регистрация аналитического сигнала).
4. Проверка результата анализа, оценка его воспроизводимости и определение окончательного результата со статистической обработкой.
Основной закон светопоглощения
При прохождении потока монохроматического излучения через поглощающую среду интенсивность прошедшего потока I согласно закону Бугера-Ламберта-Бера равна:
I
= I0 10
-
![]() ,
,
где I и I0 – интенсивности прошедшего и падающего световых потоков;
![]() - молярный коэффициент светопоглощения
при данной длине волны;
- молярный коэффициент светопоглощения
при данной длине волны;
l – толщина поглощающего слоя (длина оптического пути);
С – концентрация определяемого вещества (моль/л).
В логарифмической форме закон имеет следующий вид:
lg(I0/I)
= A =
![]() .
.
Величину А, которая характеризует поглощательную способность вещества, называют оптической плотностью.
Методы определения содержания определяемого вещества
Метод градуировочного графика.
Для
построения графической зависимости
А=f(С) измеряют
оптические плотности серии стандартных
растворов при определенном оптимальном
значении длины волны. При отсутствии
систематической ошибки и при подчинении
закону Бугера-Ламберта-Бера градуировочный
график представляет собой прямую линию,
идущую из начала координат под углом
![]() .
Для определения концентрации вещества
в исследуемом растворе – Сх
– измеряют оптическую плотность в тех
же условиях, как при построении
градировочного графика – Ах.
Методом интерполяции находят значение
Сх.
.
Для определения концентрации вещества
в исследуемом растворе – Сх
– измеряют оптическую плотность в тех
же условиях, как при построении
градировочного графика – Ах.
Методом интерполяции находят значение
Сх.
2.Метод одного стандарта применяется, если заранее известно, что анализируемая система подчиняется основному закону светопоглощения. Для нахождения Сх готовят два раствора – исследуемый и стандартный – и измеряют их оптические плотности – Сх и Сст соответственно.
Для каждого из этих растворов справедливо следующее выражение:
Ах= lCx,
Аст= lCст.
Так как и l для этих растворов одинаковы, то
![]()
![]() ;
;
Сx=Сст∙![]() .
.
Метод добавок. Раствор анализируемой пробы делится на несколько аликвот, в каждую из которых добавляют различные известные количества стандартного раствора. Проводят измерение оптических плотностей полученных растворов и строят график зависимости А=f(Сдоб.).
Искомую концентрацию Сх находят экстраполяцией графика на ось ОХ.
Аналитический вариант метода одной добавки заключается в определении оптических плотностей анализируемого раствора с концентрацией Сх – Ах, а также оптической плотности раствора с добавкой стандартного раствора Сх+доб. – Ах+доб..
В
этом случае Сx=![]() ;
или Сx=Сд
;
или Сx=Сд![]() .
.
3.Дифференциальная спектроскопия.
Дифференциальный метод применяется для:
1)повышения точности анализа при определении больших количеств веществ;
2) устранения мешающего влияния посторонних компонентов;
3) когда нарушается линейная зависимость оптической плотности от концентрации;
4) когда величина оптической плотности выходит за пределы шкалы прибора, а дальнейшее разбавление раствора нежелательно.
Сущность метода состоит в том, что оптические плотности исследуемого и стандартного растворов измеряются не по отношению к чистому растворителю с нулевым поглощением, а по отношению к раствору определяемого элемента с концентрацией Со, близкой к концентрации исследуемого раствора.
Относительная ошибка определения концентрации уменьшается с увеличением концентрации Со раствора сравнения и получается наименьшей, когда оптическая плотность исследуемого раствора и раствора сравнения почти одинаковы:
Со![]() Сх,
А’х/Ао
1.
Сх,
А’х/Ао
1.
Для определения оптимальной концентрации Со поступают следующим образом:
- в области концентраций, где не наблюдается значительных отклонений от линейности, приготавливают несколько стандартных растворов;
- измеряют относительные оптические плотности каждого последующего раствора к предыдущему и рассчитывают величину
f
= (![]() ΔА/ΔС)
Сoi,
ΔА/ΔС)
Сoi,
например,
f=
![]() .
.
где Сoi – концентрация стандартного раствора, который был использован в качестве раствора сравнения.
Тот раствор, для которого величина f окажется наибольшей, используется в дальнейшем в качестве раствора сравнения.
В дифференциальной спектроскопии может быть три варианта:
1. Концентрация раствора сравнения меньше концентрации исследуемого раствора (Со<Сх). Измеренная относительная оптическая плотность анализируемого раствора Сх и стандарта Сст находятся как разность оптических плотностей фотометрируемого раствора и стандарта:
А’x=Ax – Ao= εℓ(Cx-Co),
А’ст=Aст – Ao= εℓ(Cс-Co).
Отношение
![]() =
=![]() , откуда
, откуда
Сх=Со+ (Сст – Со).
Обозначив (Сст-Со)/А’ст=F (обратный угловой коэффициент графика), получим:
Сх=Со+F∙A’x.
В графическом варианте строят градуировочный график, снимая оптические плотности стандартов относительно раствора сравнения:
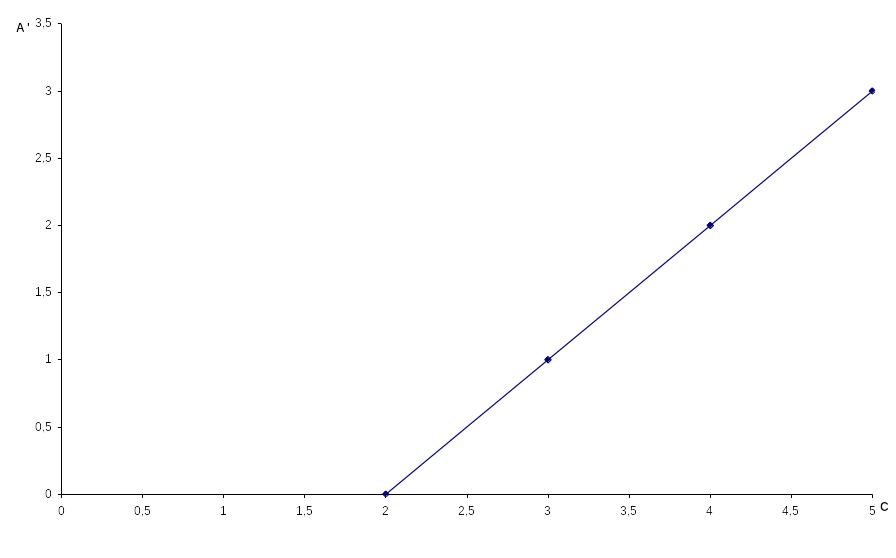
Концентрацию анализируемого раствора находят, интерполируя значение A’x на график.
Концентрация раствора сравнения больше, чем концентрация исследуемого раствора (Со>Сх). В этом случае применяют обратный порядок измерения: стандартные и анализируемые растворы условно принимают за растворы сравнения и по отношению к ним измеряют оптическую плотность нулевого раствора:
А’х= Ао – Ах,
А’ст= Ао – Аст,
тогда
Сх=Со – F∙A’x,
где
![]() .
.
В графическом варианте по оси абсцисс откладывают значения ΔС=Со-Сст, а по оси ординат – соответствующие значения относительной оптической плотности. При ΔС=0 концентрации раствора сравнения и исследуемого раствора будут одинаковы (Со=Сх), а при максимальной разности концентраций – концентрация исследуемого раствора равна нулю (Сх=0).
3. Двухстороннее (полное) дифференцирование. Двусторонним называют сочетание прямого (Сх>Со) и обратного (Сх<Со) порядка измерений. При фотометрировании исследуемых и стандартных растворов, концентрации которых больше, чем концентрация раствора сравнения, значения оптической плотности берут со знаком «плюс». Если концентрация фотометрируемых растворов меньше, чем концентрация раствора сравнения, то полученным значениям относительной оптической плотности приписывают знак «минус». Расчет неизвестной концентрации производят по формулам:
Сх=Со+F1А’х, (Со< Сх)
Сх=С о- F2А’х, (Со> Сх).
Дифференциальный метод добавок основан на сочетании дифференциального метода и метода добавок. Метод применяется в присутствии мешающих компонентов, когда необходимо создать одинаковый солевой состав в исследуемом растворе и растворе сравнения.
Необходимым условием применимости метода является строгое соблюдение линейности градировочного графика. Сущность метода заключается в проведении следующих операций:
приготавливают исследуемый раствор, разбавленный в k-раз (k >1), исследуемый раствор (Сх) и исследуемый раствор с добавкой Сд определяемого компонента;
измеряют относительные оптические плотности неразбавленного раствора – А’х – и раствора с добавкой - А’х+д, по отношению к разбавленному раствору;
неизвестную концентрацию Сх определяют по формуле:
Сx=Сд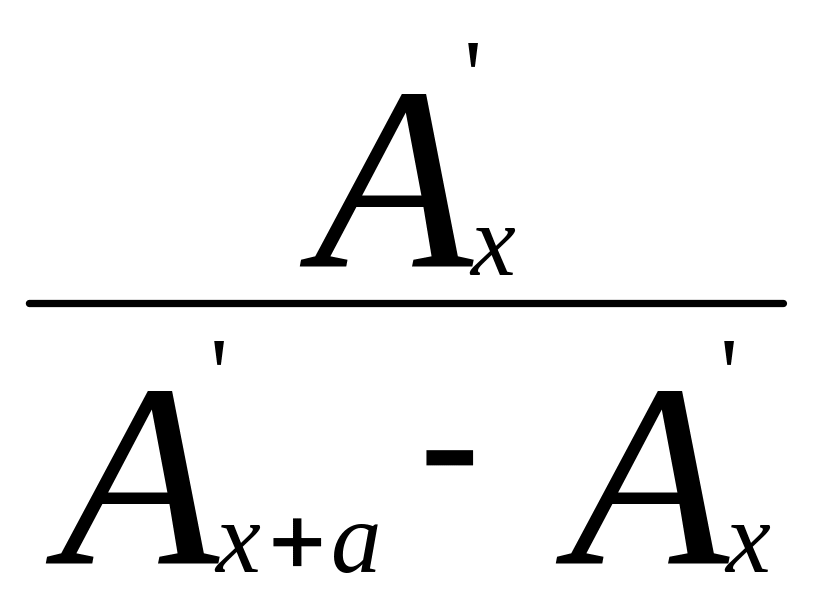
![]()
![]()
