
- •Химия радиоматериалов Лабораторный практикум
- •План лабораторных занятий по химии радиоматериалов
- •Техника безопасности при работе в лаборатории химии общие правила проведения работ
- •Правила техники безопасности
- •Правила противопожарной безопасности
- •Меры первой помощи при несчастных случаях
- •Лабораторная работа № 1
- •Лабораторная работа № 2
- •Часть 1. P-элементы III и IV групп (Алюминий. Углерод)
- •Часть 2. P-элементы V группы (Азот. Фосфор)
- •Часть 3. P-элементы VI группы (Сера)
- •Часть 4. Водород и р-элементы VII группы (Водород. Галогены)
- •Лабораторная работа № 3
- •Часть 1. D-элементы VI и VII групп (Хром. Марганец)
- •Часть 2. D-элементы VIII группы (Железо. Кобальт. Никель)
- •Лабораторная работа №4 определение качественного состава веществ
- •Лабораторная работа № 5 высокомолекулярные синтетические соединения (полимеры)
- •Приложения
- •1. Единицы измерения физических величин
- •2. Фундаментальные физические постоянные
- •3. Давление насыщенного водяного пара (р) в равновесии с водой
Часть 2. P-элементы V группы (Азот. Фосфор)
Цель работы
Изучение способов получения и физико-химических свойств p-элементов V группы.
Оборудование и реактивы
Пробирки, пробиркодержатель, фарфоровые чашки, тигель, спиртовка, спички, газоотводные трубки, холодильник, штатив, кристаллизатор, лучинка.
Железо Fe (опилки), медь (стружки и пластинка), уголь, сера черенковая, хлорид аммония NH4Cl (к), фосфат аммония (NH4)3PO4 (к), сульфат аммония (NH4)2SO4 (к), нитрат аммония NH4NO3 (к), дихромат аммония (NH4)2Cr2O7 (к), хлорид аммония NH4Cl (к), нитрат свинца PbNO3 (к), нитрат серебра AgNO3 (к), фосфат натрия Na3PO4 (к), нитрат калия КNO3 (к), нитрит натрия NaNO2 (к); растворы: аммиак NH3 • H2О, серная кислота H2SO4, азотная кислота HNO3 (разб. и конц.), перманганат калия KMnO4, нитрит калия KNO2, иодид калия KI, нитрит натрия NaNO2, хлорид железа (III) FeCl3, крахмал; индикаторы: универсальная индикаторная бумага, фенолфталеин.
Экспериментальная часть 3
Опыт 1. Получение и свойства азота
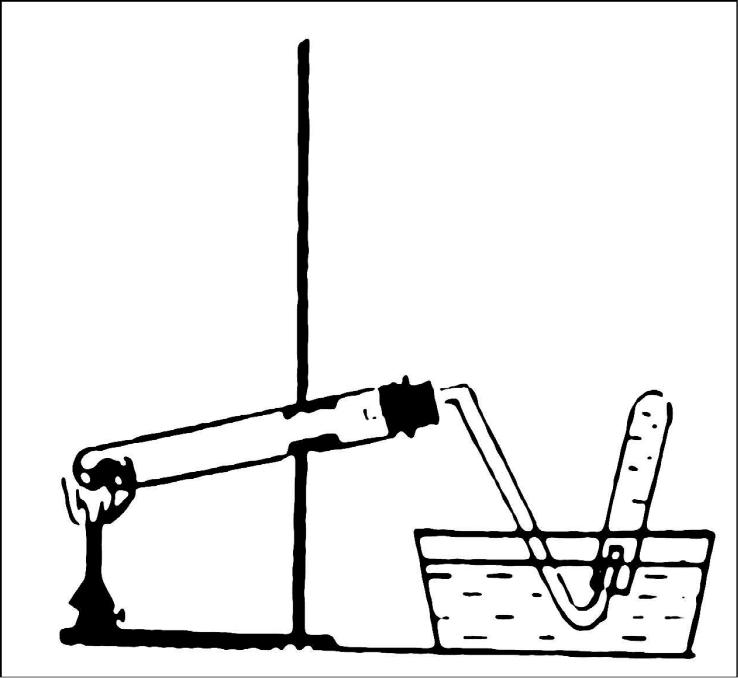
В пробирку, закрепленную в штативе (рис. 7) поместите реакционную смесь – 0,2 г нитрата калия KNO3 и 4 г железных опилок, закройте пробкой с газоотводной рубкой и перед пробкой положите кусок ваты. Вторую пробирку заполните водой и, перевернув вверх дном, поместите в кристаллизатор. Нагрейте реакционную смесь и выделяющийся газ соберите в пробирку, вытесняя воду. Закройте пробирку с газом под водой и выньте из кристаллизатора. Опишите физические свойства газообразного азота.
 ___________________________________________________
________________________________________________________________________________________________________
___________________________________________________
________________________________________________________________________________________________________
П
Рис. 7. Получение
азота
____________________________________________________
____________________________________________________
Опыт 2. Основные свойства аммиака
2.1. В пробирку налейте 1 мл раствора аммиака NH3. Обратите внимание на характерный запах раствора. Добавьте к раствору 5–6 капель фенолфталеина, затем прибавляйте по каплям разб. серную кислоту H2SO4 до обесцвечивания раствора.
________________________________________________________________________________
2.2. В пробирку налейте 1 мл раствора хлорида железа (III) FeCl3 и прибавляйте к нему раствор аммиака (NH3) до выпадения осадка гидроксида железа (III).
________________________________________________________________________________
Опыт 3. Термическое разложение солей аммония
Проверьте отношение к нагреванию фосфата, сульфата, нитрата, дихромата и хлорида аммония. Прокаливание первых трех солей проведите на крышке тигля над тягой. Хлорид аммония прокалите в стеклянной трубке, закрепленной наклонно в штативе. С обоих концов трубки положите влажную универсальную индикаторную бумагу. Напишите уравнения реакций и поясните зависимость характера термической диссоциации солей аммония от природы аниона кислоты.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Опыт 4. Свойства азотной кислоты
4.1. Прилейте к осадку Fe(OH)3, полученному в опыте 2.2, разб. азотной кислоты HNO3 до полного растворения осадка.
________________________________________________________________________________
4.2. Осторожно внесите в пробирку 10 капель конц. азотной кислоты HNO3 (тяга!) и опустите в нее медную пластинку или стружки. Отметьте выделение бурого газа NO2.
________________________________________________________________________________
________________________________________________________________________________
Опыт 5. Свойства солей азотистой кислоты
5.1. К небольшому количеству раствора KMnO4, подкисленному серной кислотой, добавьте раствор нитрита калия KNO2.
________________________________________________________________________________
________________________________________________________________________________
5.2. К подкисленному раствору иодида калия KI с несколькими каплями раствора крахмала прилейте раствор нитрита натрия NaNO2.
________________________________________________________________________________
________________________________________________________________________________
Опыт 6. Термическое разложение нитратов (тяга!)
6.1. Прокалите в разных пробирках нитраты калия, свинца и серебра. Обратите внимание на окраску газообразных продуктов, выделяющихся при этом, и испытайте их тлеющей лучинкой.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
6.2. Расплавьте в пробирке немного KNO3 и бросьте туда кусочек тлеющего угля.
________________________________________________________________________________
После окончания реакции бросьте в эту же пробирку кусочек черенковой серы.
________________________________________________________________________________
________________________________________________________________________________
Опыт 7. Гидролиз солей фосфорной кислоты
Осуществите гидролиз кислых и средней солей ортофосфорной кислоты. Определите pH среды с помощью универсального индикатора.
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
