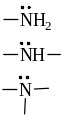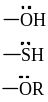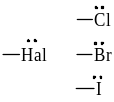Индуктивный эффект
Индуктивный эффект – это передача электронного влияния по цепи -связи.
Известно, что связь между атомами с различной электроотрицательностью поляризована, т.е. смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов обозначаемых греческой буквой «дельта» ().
Такое электронное смещение называется индуктивным эффектом и обозначается буквой I и стрелкой , направленной вдоль связи от менее электроотрицательного и более электроотрицательному. Индуктивный эффект передается по цепи с затуханием:
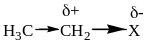 ,
,
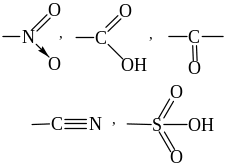
X = Наl, НО , НS , NН2 и др.
Направление индуктивного эффекта заместителя качественно оценивают, сравнивая с со связью С-Н, пологая её неполярной, а индуктивный эффект водорода равным нулю: I (Н) = 0.
Индуктивный эффект может быть положительным или отрицательным.
Если заместитель Х притягивает электроны химической связи сильнее, чем атом Н, то он проявляет –I, т.е. заместители снижают электронную плотность в системе σ-связей, и их называют электроноакцепторными заместителями. (см. табл.1). В нашем примере Х проявляет –I.
Если заместитель Х притягивает электроны связи слабее, чем атом Н, то он проявляет +I, т.е. заместители повышают электронную плотность в цепи σ-связей по сравнению с атомом водорода и являются элекронодонорными заместителями (см. табл.1). К таким заместителям относятся атомы с низкой электроотрицательностью – все алкилы (R = СН3 , С2Н5 и т.д.), Меn+ проявляют +I.
Мезомерный эффект
М езомерный
эффект
(эффект
сопряжения)
– это влияние заместителя, передаваемое
по сопряженной системе -связей
(виды сопряжения ,
и р,).
Обозначается буквой М
и изогнутой стрелкой ,
начинающейся у центра электронной
плотности и завершающейся в том месте,
куда смещается электронная плотность.
езомерный
эффект
(эффект
сопряжения)
– это влияние заместителя, передаваемое
по сопряженной системе -связей
(виды сопряжения ,
и р,).
Обозначается буквой М
и изогнутой стрелкой ,
начинающейся у центра электронной
плотности и завершающейся в том месте,
куда смещается электронная плотность.
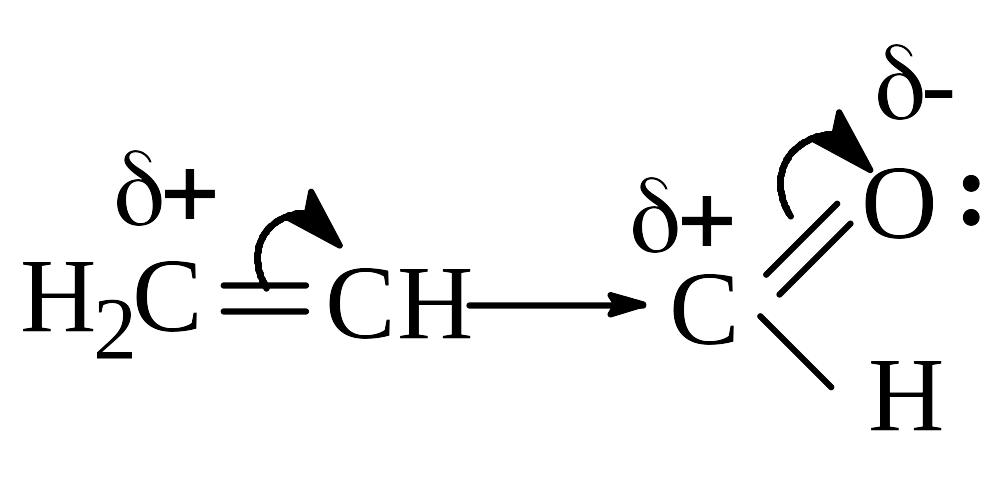
Этот эффект проявляют заместители, связанные с sp2- или sp-гибридизованным атомом. Благодаря подвижности p-электронов, М-эффект передается по цепи сопряжения без затухания.
Мезомерный эффект может быть положительным или отрицательным.
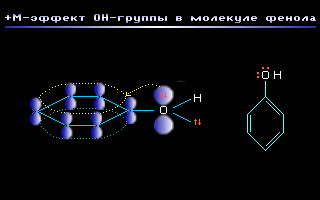
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы с одинарными связями (см. табл.1), которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения. +М-эффект характерен, например, для групп –OH (гидроксильная группа) и –NH2 (аминогруппа).
Так, в молекуле фенола C6H5OH группа -OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения:
-М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя (см. табл.1).
-М-эффект характерен для групп, имеющих в составе двойную связь, например, >C=O (альдегидная группа), COOH (карбоксильная группа), -NO2 (нитрогруппа) и др. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Например в молекуле бензальдегида:
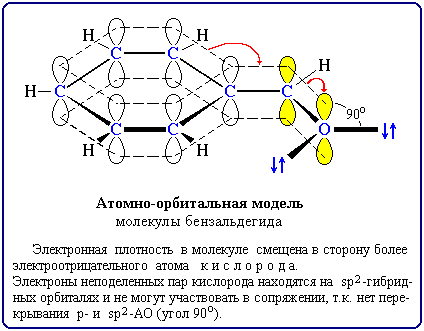
В этом примере p-орбиталь кратной связи C=O и sp2-орбитали с неподеленными парами электронов атома кислорода расположены перпендикулярно друг другу, т.е. их перекрывание невозможно и ни одна электронная пара кислорода не может передаваться в p-систему. Следовательно, группа C=O проявляет не +М-, а –М-эффект.
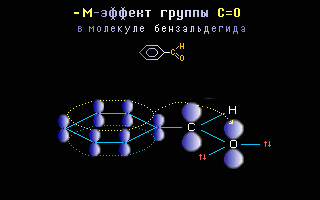
Примеры:
Акролеин |
, - сопряжение Альдегидная группа проявляет –М. |
Заместитель, притягивающий электроны из сопряженной системы и проявляющий –М называется электроноакцепторным заместителем (электроноакцептор, ЭА).
Заместитель, отдающий электроны в сопряженную систему и проявляющий +М называется электронодонорным заместителем (электронодонор, ЭД).
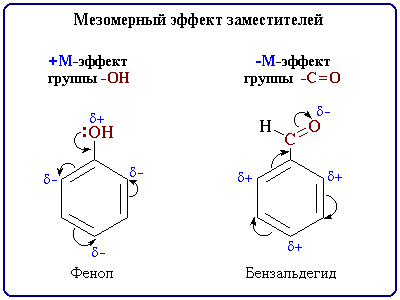
Таблица 1
Электронные эффекты заместителей
Заместители |
±I (ЭД/ЭА) |
±М (ЭД/ЭА) |
Аlk- (R-): СН3-, С2Н5- и др. |
+I (ЭД) |
- |
|
–I (ЭА) |
+M (ЭД) |
|
–I (ЭА) |
+M (ЭД) |
|
–I (ЭА) |
+M (ЭД) |
|
–I (ЭА) |
–M (ЭА) |