
Экспериментальная установка
Схема установки для исследования эффекта Джоуля — Томсона представлена на рисунке 2. Газ из области атмосферного давления Р1 проходит через множество узких и длинных каналов пористой перегородки в область с пониженным давлением Р2. Перепад давления Р = Р1 - Р2 из-за большого сопротивления каналов может быть заметным даже при малой скорости течения газа в трубке. Величина эффекта Джоуля – Томсона определяется по разности температуры газа до и после перегородки.
Основным элементом установки является трубка с пористой перегородкой 2, через которую пропускается исследуемый газ (воздух). Трубка имеет длину 140 мм и сделана из стекла, обладающего, как известно, малой теплопроводностью. Внутренний диаметр трубки d = 9 мм, толщина стенок 0,9 м. Трубка герметично переходит в трубопроводы: один для подачи газа, он имеет удлинение в виде змеевика, другой для подсоединения к форвакуумному насосу 5 (ФВН). Стеклянная трубка вместе со змеевиком 4 помещается в воду термостата для поддержания постоянной температуры.
Р1
Р2
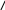
Рис. 2. Схема установки для изучения эффекта Джоуля — Томсона
Медный змеевик 4 омывается водой и нагревает медленно протекающий через него газ до температуры воды в термостате. Требуемая температура воды устанавливается и поддерживается во время эксперимента при помощи блока регулировки термостата.
Газ после пористой перегородки выходит из области с атмосферным давлением Р1 в область с давлением Р2, создаваемым форвакуумным насосом, разность давлений на входе и на выходе трубки Р =P1 – P2 составляет одну атмосферу.
Пористая
перегородка — это хорошо утрамбованная
вата, расположенная внутри стеклянной
трубки по всей её длине. Пористость и
толщина слоя ваты подобраны так, чтобы
обеспечить оптимальный поток воздуха
(около 10 см3/с)
при перепаде давлений
![]() ;
при этом эффект Джоуля – Томсона создает
достаточную разность температур.
;
при этом эффект Джоуля – Томсона создает
достаточную разность температур.
Разность температур газа до перегородки и после нее измеряется дифференциальной термопарой медь — константан. Константановая проволока диаметром 0,1 мм соединяет спаи 3, а медные проволоки (того же диаметра) подсоединены к микровольтметру 1 (ЦВ). Отвод тепла через проволоку столь малого сечения пренебрежимо мал.
Для точного задания и поддержания требуемой постоянной температуры при проведении измерений в данной работе используется водяной термостат (устройство и описание его работы см. приложение 5).
Теория эксперимента
В данной лабораторной работе находится величина коэффициента дифференциального эффекта Джоуля — Томсона для воздуха
![]() ,
(10)
,
(10)
где – разность температур воздуха до перегородки и после нее, измеряемая термопарой, – перепад давлений, равный в нашей лабораторной работе 1 атм.
По
результатам измерения
![]() из полученного
ранее соотношения (9) можно найти также
температурный коэффициент объемного
расширения воздуха
из полученного
ранее соотношения (9) можно найти также
температурный коэффициент объемного
расширения воздуха
![]() .
(11)
.
(11)
Дальнейшие расчеты могут быть произведены только в том случае, если известна зависимость объема газа от давления и температуры. Предположим, что газ удовлетворяет уравнению Ван-дер-Ваальса
(P + a/V2)(V-b) = RT. (12)
Продифференцируем это равенство по Т, считая Р постоянным:
![]()
откуда
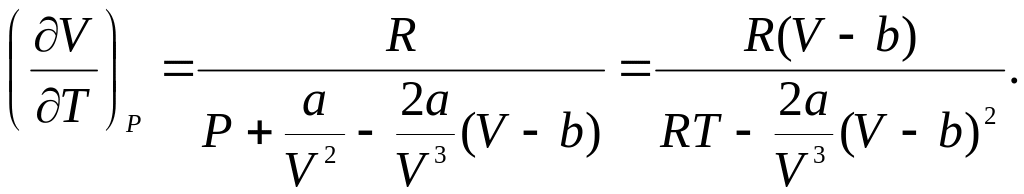 (13)
(13)
Считая газ не очень плотным и отбрасывая величины второго порядка относительно а и b, получим
![]() (14)
(14)
Подставив
(dV/dT)p
в выражение
для
![]() ,
получим
,
получим
![]() .
(15)
.
(15)
Из формулы (15) видно, что эффект Джоуля — Томсона для не очень плотного газа зависит от соотношения величин а и b, которые оказывают противоположное влияние на знак эффекта. Если силы взаимодействия между молекулами велики, так что превалирует «поправка на давление», то основную роль играет член, содержащий а, и
T/P>0,
т. е. газ при расширении охлаждается (T<0), так как Р<0).
В обратном случае (малые а)
T/Р<0,
т. е. газ нагревается (T>0, так как P<0).
Этот результат нетрудно понять из энергетических соображений. Как мы уже знаем, у идеального газа эффект Джоуля – Томсона отсутствует. Идеальный газ отличается от реального тем, что в нем можно пренебречь потенциальной энергией взаимодействия молекул. Рассмотрим газ, для которого можно пренебречь поправкой b. Этот случай относится к столь малым размерам молекул, что их можно считать за точечные. Это означает, что между молекулами на сколько-нибудь значительных расстояниях друг от друга не существует заметных сил отталкивания. Приходится принимать во внимание (кроме моментов столкновения) лишь силы притяжения, которым соответствует зависимость потенциальной энергии EР от расстояния r изображенная на рис. 3б.
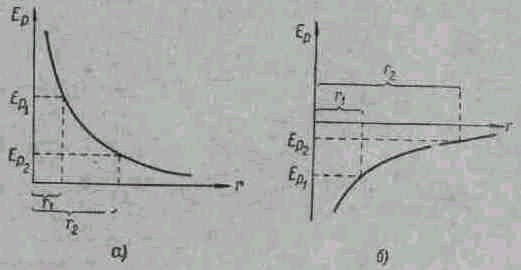
Рис. 3. Потенциальные энергии взаимодействия молекул: а) при наличии сил отталкивания; б) при наличии сил притяжения.
Потенциальная энергия отрицательна и с увеличением r ее численное значение уменьшается, поэтому
![]() .
.
Возрастание
потенциальной энергии молекул происходит
за счет их кинетической энергии –
температура газа при расширении падает
(![]() ,
положительный эффект Джоуля–Томсона).
Таким образом, газ, для которого можно
пренебречь поправкой b
уравнения
Ван-дер-Ваальса, но для которого поправка
а
играет существенную роль, охлаждается
при расширении.
,
положительный эффект Джоуля–Томсона).
Таким образом, газ, для которого можно
пренебречь поправкой b
уравнения
Ван-дер-Ваальса, но для которого поправка
а
играет существенную роль, охлаждается
при расширении.
Если, наоборот, поправка а мала, то следует считать силы притяжения между молекулами исчезающе малыми и учитывать лишь силы отталкивания. Тогда потенциальная энергия взаимодействия молекул EР, как функция расстояния между ними r, представится кривой, изображенной на рис. 3а.
Большему
давлению газа
![]() соответствуют меньшие средние расстояния
между молекулами
соответствуют меньшие средние расстояния
между молекулами
![]() ;
меньшему давлению
;
меньшему давлению
![]() соответствуют большие средние расстояния
соответствуют большие средние расстояния
![]() .
Отсюда, как видно из рис. 3а, с уменьшением
давления внутренняя потенциальная
энергия убывает:
.
Отсюда, как видно из рис. 3а, с уменьшением
давления внутренняя потенциальная
энергия убывает:
![]() .
.
Т.е.
потенциальная энергия падает, а
кинетическая энергия молекул увеличивается
– температура газа возрастает (![]() ,
отрицательный эффект Джоуля–Томсона).
Таким образом, мы приходим к выводу:
газ, для которого можно пренебречь
поправкой а
уравнения Ван-дер-Ваальса, но для
которого поправка b
играет
заметную роль, нагревается при расширении.
,
отрицательный эффект Джоуля–Томсона).
Таким образом, мы приходим к выводу:
газ, для которого можно пренебречь
поправкой а
уравнения Ван-дер-Ваальса, но для
которого поправка b
играет
заметную роль, нагревается при расширении.
Для одного и того же газа, в зависимости от его температуры и давления, может играть большую роль то поправка b, то поправка а. Поэтому один и тот же реальный газ в зависимости от внешних условий дает то положительный, то отрицательный эффект Джоуля – Томсона.
При
некоторой температуре коэффициент
![]() обращается в нуль. Это происходит, когда
(2a/RT)-b=0,
т.е. при температуре, которая называется
температурой инверсии.
обращается в нуль. Это происходит, когда
(2a/RT)-b=0,
т.е. при температуре, которая называется
температурой инверсии.
Тинв = 2а/Rb. (16)
Используя связь между коэффициентами а и b и критической температурой Tкр газа Ван-дер-Ваальса, найдем
Tинв = (27/4)Tкр. (17)
При температуре Тинв эффект Джоуля – Томсона меняет знак: ниже температуры инверсии эффект положителен ( >0, газ охлаждается), выше Tинв эффект отрицателен ( <0, газ нагревается).
Температура инверсии у всех газов лежит значительно выше критической. Для большинства газов Tинв/Tкр= 5–8. Например, для гелия Тинв=46 К, Tкр =5,2 К; для водорода Tинв =205 К, Ткр =33 К; для азота Тинв=604 К, Tкр =126 К; для воздуха Tинв =650 К, Tкр=132,6 К; для углекислого газа Tинв =2050 К, Tкр =304 К. Температура инверсии у гелия и водорода значительно ниже комнатной, поэтому при обычных температурах эти газы при расширении нагреваются. Температура инверсии остальных газов выше комнатной, и при нормальных условиях температура при расширении газа падает.
Сравнивая приведенные значения Tинв и Ткр, можно убедиться в том, что предсказания, следующие из формулы Ван-дер-Ваальса, у реальных газов выполняются не очень хорошо. Правильно передавая качественную картину поведения реальных газов, формула Ван-дер-Ваальса не претендует на хорошее количественное описание этой картины.
Вернемся к влиянию правой части (2) на изменение температуры расширяющегося газа. Для этого сравним изменение температуры, происходящее вследствие эффекта Джоуля — Томсона, с изменением температуры, возникающим из-за изменения кинетической энергии газа. Увеличение кинетической энергии газа вызывает заметное — и приблизительно одинаковое— понижение его температуры как у реальных, так и у идеальных газов. Поэтому при оценках нет смысла пользоваться сложными формулами для газа Ван-дер-Ваальса.
Заменяя в формуле (2) U через СV Т и РV через RТ, найдем:
(R + CV) (T1 – T2) = ,
или
T
= (
/ 2Cp)
![]() .
.
Пусть расход газа Q на выходе из пористой перегородки не превышает 10 см3/с, а диаметр трубки мал (не более 1 см). В этом случае
![]()
Скорость
![]() газа у входа в трубку относится к
скорости
газа у входа в трубку относится к
скорости
![]() у выхода из нее как давление Р2
относится к
Р1.В
нашей установке Р1 =1 атм, а Р2 ≈
10-5 атм,
поэтому
у выхода из нее как давление Р2
относится к
Р1.В
нашей установке Р1 =1 атм, а Р2 ≈
10-5 атм,
поэтому
![]()
Для
воздуха
![]() ;
имеем
;
имеем
T
= (
/ 2Cp)![]() .
.
Это изменение температуры ничтожно мало по сравнению с измеряемым эффектом.
