
- •Кафедра физики изучение спектра атома водорода
- •Кемерово 2011 лабораторная работа № 384 изучение спектра атома водорода
- •3. Описание экспериментальной установки
- •4. Теоретические основы работы
- •5. Выполнение работы
- •Список рекомендуемой литературы
- •Атом водорода в квантовой механике Уравнение Шредингера для электрона
- •Энергия
- •Квантовые числа
- •Спектр водорода
- •Изучение спектра атома водорода
Спектр водорода
Квантовые числа , и позволяют более полно описать спектр испускания (поглощения) атома водорода.
Испускание и
поглощение света происходит при переходах
электрона с одного уровня на другой. В
квантовой механике для оптических
спектров вводятся правила
отбора,
ограничивающие число возможных переходов
в атоме, связанных с испусканием и
поглощением света. Доказано, что для
дипольного излучения электрона,
движущегося в центрально-симметричном
поле ядра, могут осуществляться только
такие переходы, при которых изменение
орбитального квантового числа
![]() удовлетворяет условию
удовлетворяет условию
![]() ,
изменение магнитного квантового числа
,
изменение магнитного квантового числа
![]() .
Учитывая число возможных состояний,
соответствующих данному
,
и правила отбора, можно утверждать, что
в атоме водорода существуют следующие
энергетические переходы:
.
Учитывая число возможных состояний,
соответствующих данному
,
и правила отбора, можно утверждать, что
в атоме водорода существуют следующие
энергетические переходы:
![]() ,
(9)
,
(9)
![]() .
(10)
.
(10)
Спектральные линии атома водорода, соответствующие этим переходам, представлены на рис. 5.
Выражение (7), полученное в ходе решения уравнения Шредингера, определяет энергию атома водорода в стационарных состояниях и позволяет вычислить частоту энергетического перехода (спектральных линий) атома водорода. При переходе атома водорода из стационарного состояния в стационарное состояние с меньшей энергией испускает квант:
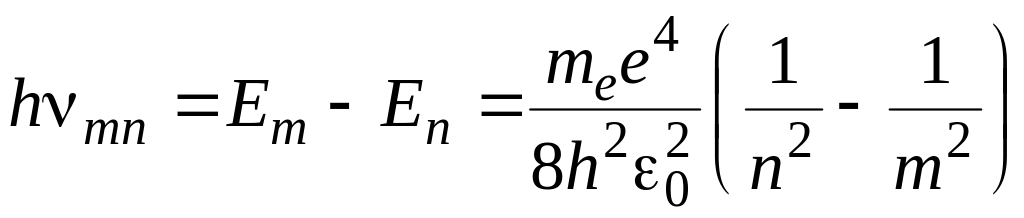 ,
,
откуда частота излучения
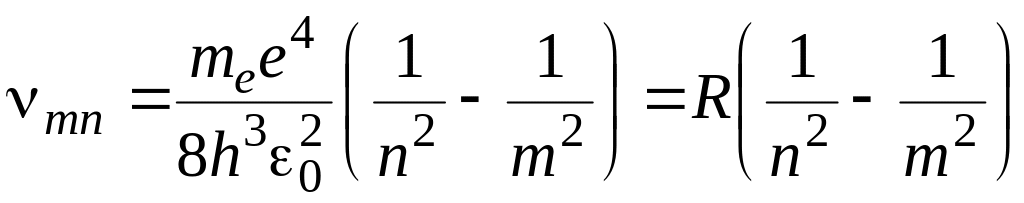 ,
(11)
,
(11)
Выражение (11)
называют формулой Бальмера, а величину
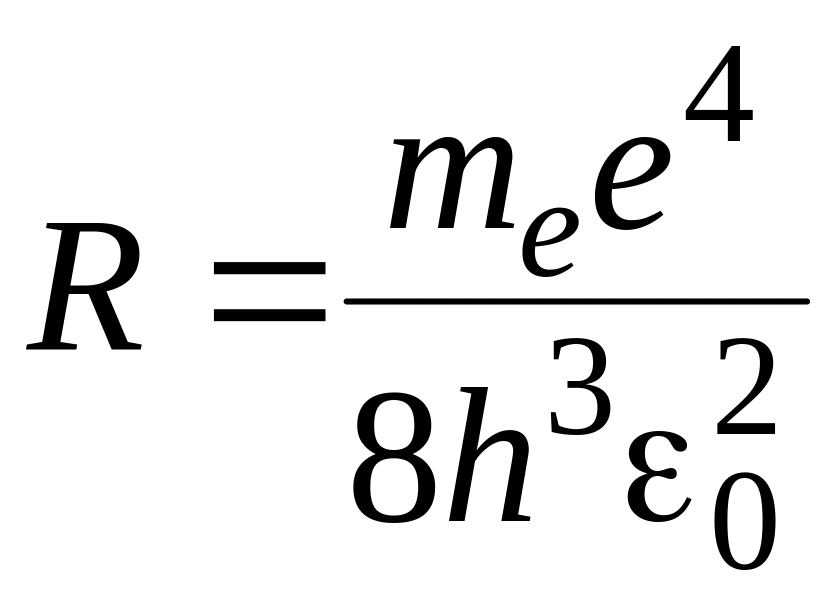 – постоянной Ридберга. В формуле (11)
и
– главные квантовые числа, причем
определяет спектральную серию,
– отдельные линии серии.
– постоянной Ридберга. В формуле (11)
и
– главные квантовые числа, причем
определяет спектральную серию,
– отдельные линии серии.
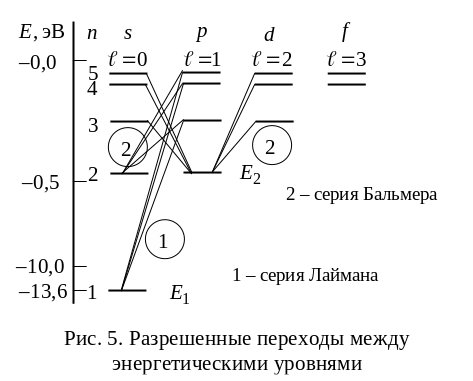
Подставляя в
формулу Бальмера
![]() и
и
![]() ,
получим группу линий, образующих серию
Лаймана
(рис. 5). Все линии этой серии расположены
в ультрафиолетовой области спектра.
При подстановке
и соответствующих значений
получим серию
Бальмера,
линии которых расположены в видимой
области спектра. Линии остальных серий
(Пашена, Брэкета, Пфунда, Хэмфри) получаются
при
,
получим группу линий, образующих серию
Лаймана
(рис. 5). Все линии этой серии расположены
в ультрафиолетовой области спектра.
При подстановке
и соответствующих значений
получим серию
Бальмера,
линии которых расположены в видимой
области спектра. Линии остальных серий
(Пашена, Брэкета, Пфунда, Хэмфри) получаются
при
![]() соответственно. Они находятся в
инфракрасной области спектра.
соответственно. Они находятся в
инфракрасной области спектра.
Теоретически установленные спектральные линии и соответствующие им частоты находятся в хорошем согласии с экспериментально наблюдаемым спектром атома водорода.

Составители
Геннадий Иванович Зайцев
Полина Федоровна Яковлева
Изучение спектра атома водорода
Методические указания
для подготовки к выполнению лабораторной работы № 384
для студентов технических специальностей
Рецензент В. В. Дырдин
Печатается в авторской редакции
Подписано в печать ......2011. Формат 60´84/16.
Бумага офсетная. Отпечатано на ризографе. Уч.-изд. л. 0,8.
Тираж экз. Заказ
ГУ КузГТУ, 650000, Кемерово, ул. Весенняя, 28.
Типография ГУ КузГТУ, 650000, Кемерово, ул. Д. Бедного, 4 а.
