
- •Лабораторно-практическое занятие № 1 Фармацевтический анализ лекарственных средств группы карбоновых кислот и их производных
- •Калия ацетат (Kalii acetas)
- •Красно-бурый
- •Катион ацетония
- •Кальция лактат (Calcii lactas)
- •Натрия цитрат (Natrii citras)
- •Тринатриевая соль 2-гидроксипропан-1,2,3-трикарбоксилат
- •Кальция глюконат (Calcii gluconas)
- •Определение подлинности проводят по иону кальция и аниону глюконовой кислоты.
- •Спектр стандартного образца кальция глюконата.
- •Оценка чистоты. Для субстанции значение pH 2% водного раствора 6,0-7,2.
- •Количественное определение проводят методом комплексонометрического титрования. Натрия вальпроат (Natrii valproat)
- •Натриевая соль 2-пропилпентаноата
- •Аскорбиновая кислота (Acidum ascorbinicum )
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств группы карбоновых кислот и их производных
- •2.2. Подлинность
- •4. Защита лабораторной работы – 30 мин.
Катион ацетония
При титровании происходит взаимодействие двух ионных пар с регенерацией растворителя:
CH3COOKH+∙CH3COO- + CH3COOH2+ ∙ClO4- KClO4 + 3CH3COOH
Кальция лактат (Calcii lactas)

С6H10CaO6×5H2O Mr 308,2
Кальция лактат служит источником ионов кальция, используется как противоаллергическое средство, применяется при кровотечениях, отравлениях солями магния, щавелевой и фтороводородной кислотами, и их солями оксалатами и фторидами.
Описание. Кальция лактат представляет собой белый мелкокристаллический порошок, почти без запаха, на воздухе выветривается. Мало растворим в холодной воде, легко растворим в горячей воде, очень мало растворим в спирте, эфире, хлороформе.
Определение подлинности проводят по аниону молочной кислоты и иону кальция.
Реакции на ион кальция:
С оксалатом аммония образуется осадок оксалата кальция, нерастворимый в уксусной кислоте, но растворимый в хлороводородной кислоте:
Ca2+ + (NH4)2C2O4 CaC2O4 + NH4+
белый
С раствором калия гексацианоферрата(II) в присутствии хлорида аммония образуется кристаллический осадок:
Ca2+ + 2NH4+ + [Fe(CN)6]4- Сa(NH4)2[Fe(CN)6]
белый
Реакции на анион молочной кислоты (лактат):
Субстанцию кальция лактата растворяют в горячей воде, подкисляют разведенной серной кислотой, добавляют перманганат калия до красно-фиолетового окрашивания и нагревают. Появляется запах ацетальдегида и происходит обесцвечивание раствора:
5[CH3CH(OH)COO]2Ca + 4KMnO4 + 11H2SO4 ®
10CH3CHO + 2K2SO4 + 4MnSO4 + 10CO2+ 5CaSO4 +16H2O
Оценка чистоты. В субстанции кальция лактата допустимыми примесями являются: хлориды, сульфаты, ионы натрия, железа, тяжёлых металлов, восстанавливающих веществ. Недопустимыми примесями являются ионы бария, летучие жирные кислоты (после нагревания с фосфорной кислотой не должно быть постороннего запаха). Потеря в массе при высушивании не более 22-27%. Определение проводят для навески массой 0,5 г при высушивании при 125 °C в течение 3 ч.
Количественное определение проводят методом комплексонометрического титрования.
Титрант – раствор ЭДТА. Индикатор – кислотный хром темно-синий. Титруют до сине-фиолетового окрашивания.
Натрия цитрат (Natrii citras)
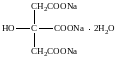
Тринатриевая соль 2-гидроксипропан-1,2,3-трикарбоксилат
C6H5Na3O7 ×2H2O Mr 294,1
Натрия цитрат - антикоагулянтное средство, которое снижает свертываемость крови, связывая ионы Ca2+ (IV плазменный фактор свертывания крови) препятствуя гемокоагуляции (in vitro!). Увеличивает содержание Na+ в организме, повышает щелочные резервы крови. Он используется для снижения кислотности при периферических почечных ацидозах и снижения дискомфорта при инфекциях мочеполовой системы, например при цистите.
Описание. Натрия цитрат представляет собой бесцветные кристаллы или белый кристаллический порошок без запаха, выветривающийся на воздухе. Легко растворим в воде, нерастворим в спирте.
Определение подлинности проводят по иону натрия и аниону лимонной кислоты.
Реакции на ион натрия:
Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Реакция на цитрат ион с CaCl2: при добавлении к цитрату натрия раствора CaCl2 на холоду раствор остаётся прозрачным, но при нагревании он мутнеет вследствие образования нерастворимой в горячей воде кальциевой соли лимонной кислоты; при охлаждении осадок снова растворяется:

Оценка чистоты. Недопустимыми являются примеси мышьяка, солей щавелевой и винной кислоты.
Мышьяк открывают с помощью реакции Буго-Тилле. При этом не должно быть бурого окрашивания:
As3+ (As5+) + NaH2PO2 + НСI ® As¯ + H3PO3
Количественное определение проводят методом неводного титрования в среде безводной уксусной кислоты. Титрант – HClO4. Индикатор - п-нафтолбензол, титруют до зеленой окраски.
