- •Первый закон термодинамики – это закон сохранения энергии, согласно которому энергия ниоткуда не берется и никуда не девается, а только переходит из одной формы в другую.
- •Возможно несколько вариантов изменения сумм энтальпий образования и энтропий веществ в ходе процесса.
- •Факторы, влияющие на скорость химической реакции
- •Обратимые и необратимые реакции
- •Химическое равновесие
- •1. Установление равновесия
- •2. Смещение химического равновесия
Лекция 4
Химическая термодинамика, равновесие и кинетика химических реакций
Химическая термодинамика – раздел физической химии, использующий законы термодинамики для описания процессов в химических системах – их направления и степени прохождения процесса. Предмет химии – химическая реакция. В результате химической реакции исчезают одни и образуются другие вещества. При этом обязательно выделяется или поглощается энергия. Таким образом, химическая реакция состоит в изменении, во-первых, строения и, во-вторых, энергии системы, испытывающей химическое превращение.
Реакцию,
протекающую при постоянном объеме (в
замкнутом реакторе), характеризуют
внутренней энергией (U), а при
постоянном давлении в открытом сосуде
– энтальпией (Н). Для тех, кто проводит
реакции в открытых сосудах, более важной
величиной является энтальпия образования,
обозначенная буквой Н (от англ. heat
– теплота). Существует шкала, позволяющая
сопоставлять энтальпии образования
всех веществ. Принято, что нулю на данной
шкале соответствуют простые вещества.
Если простое вещество способно
существовать в нескольких аллотропных
формах, то нуль обычно относится к
наиболее устойчивой из них. Так, нулевую
энтальпию образования имеет кислород,
а не озон, графит, а не алмаз. Если при
образовании сложного вещества из простых
энергия затрачивается, то значение
энтальпии для данного вещества
положительное, а если выделяется, то
отрицательное. Поскольку абсолютную
энтальпию образования вещества определить
невозможно, оперируют только с их
разностями
![]() H
в искусственно введенной шкале. Разница
энтальпий образования соединений обычно
зависит от температуры, при которой
проводится процесс. В связи с этим в
справочниках, как правило, указывают
стандартное (относящееся к температуре
25 °С) значение энтальпии, что обозначают
верхним индексом (0). Обозначение
энтальпии образования соединения (из
простых веществ) снабжают также нижним
индексом (f) (от англ. formation –
образование). Тогда для стандартной
энтальпии образования воды имеем:
H
в искусственно введенной шкале. Разница
энтальпий образования соединений обычно
зависит от температуры, при которой
проводится процесс. В связи с этим в
справочниках, как правило, указывают
стандартное (относящееся к температуре
25 °С) значение энтальпии, что обозначают
верхним индексом (0). Обозначение
энтальпии образования соединения (из
простых веществ) снабжают также нижним
индексом (f) (от англ. formation –
образование). Тогда для стандартной
энтальпии образования воды имеем:
![]() Кроме энтальпий образования в справочниках
приводят и другие виды энтальпий,
например, стандартные энтальпии сгорания,
показывающие, сколько энергии выделяется
при сгорании 1 моль вещества. Энтальпия
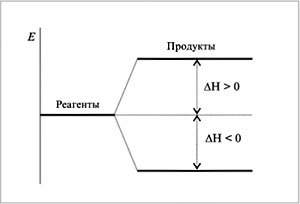
(русский эквивалент этого слова –
«теплосодержание») системы возрастает
в эндотермическом процессе (когда
система поглощает теплоту),
Н
> 0, и убывает в экзотермическом,
Н
< 0 :
Кроме энтальпий образования в справочниках
приводят и другие виды энтальпий,
например, стандартные энтальпии сгорания,
показывающие, сколько энергии выделяется
при сгорании 1 моль вещества. Энтальпия
(русский эквивалент этого слова –
«теплосодержание») системы возрастает
в эндотермическом процессе (когда
система поглощает теплоту),
Н
> 0, и убывает в экзотермическом,
Н
< 0 :
|
Изменение энтальпии в эндо- и экзотермических процессах |
При этом выполняется закон Гесса: «Если химическая реакция проводится при постоянном давлении или постоянном объеме, то ее тепловой эффект не зависит от того, по какому пути (через образование каких промежуточных соединений) она осуществлена.» Тепловой эффект — это разница между уровнем энергии реагентов и уровнем энергии продуктов, которая, очевидно, зависит только от свойств участников реакции до нее и после. А путь может быть вообще неизвестен. Энтальпии очень многих реакций найдены экспериментально, часто с использованием калориметров. Однако это осуществлено далеко не для всех процессов. Во-первых, их слишком много, возможно, практически бесконечное число. Во-вторых, отнюдь не все реакции можно провести в калориметре, например реакцию, происходящую в зеленых растениях.
Легко пояснить закон Гесса с помощью следующего примера. Углекислый газ из углерода и кислорода можно получить двумя путями:
|
Графическое истолкование закона Гесса на примере превращения углерода в углекислый газ |
1) в одну стадию – прямым сжиганием в избытке кислорода;
2) в две стадии – получением сначала монооксида углерода и его последующим сжиганием.
Согласно закону Гесса:
H1 = H2 + H3.
Из закона Гесса вытекают три важных следствия.
Следствие 1. Энтальпия реакции равна разности энтальпий образования продуктов и реагентов:
Hр
=
![]() Hf
(прод.)
–
Hf
(реаг.).
Hf
(прод.)
–
Hf
(реаг.).
Так, если уравнение реакции в общем виде записать следующим образом:
aА + bB = cC + dD, то
Hр = c Hf(C) + d Hf(D) – a Hf(A) – b Hf(B).
Следствие 2. Энтальпия реакции равна разности энтальпий сгорания реагентов и продуктов:
Hр = Hсг(реаг.) – Hсг(прод.).
Для реакции:
aА + bB = cC + dD,
Hр = a Hсг(А) + b Hсг(B) – c Hсг(C) – d Hсг(D).
Следствие 3. Термохимические уравнения реакций можно складывать и вычитать, умножать и делить, записывать справа налево, несмотря на подчас практическую неосуществимость обратных реакций.
Это следствие приходит на помощь, когда соединения либо не удается получить при непосредственном взаимодействии простых веществ, либо они не горят.
Иногда вместо энтальпий реакций используют теплоты реакций, а вместо энтальпий образования веществ их теплоты образования. Теплоты реакций и теплоты образования связаны с соответствующими энтальпиями простым соотношением: Q = – H.
Первый закон термодинамики – это закон сохранения энергии, согласно которому энергия ниоткуда не берется и никуда не девается, а только переходит из одной формы в другую.
Мы живем в мире, где большинство событий необратимо. Необратимо и большинство химических изменений в мире, так что мир изменяется самопроизвольно в некотором направлении. Что значит «самопроизвольно»?
Самопроизвольным называется процесс, происходящий без затраты работы. Наоборот, в его результате работа может быть получена. Работа — это мера упорядоченной передачи энергии от одной системы к другой. Иная возможность передачи энергии — теплота — мера передачи энергии от одного тела к другому путем неупорядоченных, хаотических столкновений частиц веществ, образующих эти тела, — явление теплопроводности.
Всякая система стремится перейти в состояние с наименьшей энергией. Самопроизвольно происходят только экзотермические процессы.
Однако существование обратимых химических реакций, которые, если они экзотермичны в одном направлении, то эндотермичны в другом, опровергает это утверждение. Закон сохранения энергии гласит, что энергия Мира постоянна. Если энергия какой-либо системы понижается, то неминуемо в другой системе она повышается.
Для объяснения происходящих в мире изменений необходимо установить физическую причину. Энтропия! Мерой беспорядка (W) служит физическая величина – энтропия S: чем выше значение энтропии, тем больше беспорядка, и чем оно ниже, тем больше порядка. Для реальных веществ величина W невообразимо велика, так что оперировать ею чрезвычайно неудобно. На практике мерой вероятности существования системы в том или другом состоянии является энтропия S, связанная с W уравнением Больцмана: S = k lnW, где k = R/NA = 1,38•10–23 Дж/К – константа Больцмана, lnW – натуральный логарифм величины термодинамической вероятности. С увеличением W — числа способов, которым может быть реализовано данное состояние вещества, – возрастает энтропия S.
Размерность энтропии определяется размерностью константы Больцмана. Для вещества величина энтропии обычно дается в расчете на 1 моль, тогда ее размерность Дж/(К•моль). Наименьшая энтропия у веществ в кристаллическом состоянии и максимальная у газов. Жидкость в этом отношении занимает промежуточное положение. Строение идеального кристалла при абсолютном нуле градусов Кельвина совершенно однозначно, т.е. W = 1 и в соответствии с уравнением Больцмана S = 0. В идеально упорядоченном состоянии при температуре абсолютного нуля энтропия вещества равна 0. Таким образом, зная структуру вещества, можно вычислить его энтропию.
Чем больше в системе вещества, тем больше ее энтропия. Чем выше температура, тем больше число энергетических состояний, в которых могут находиться частицы, образующие данное вещество, тем больше энтропия. Это изменение энтропии определяется формулой S = Q/T, где S — изменение энтропии системы, Q — количество теплоты, поглощенной системой (тогда энтропия системы увеличивается, S > 0) или потерянной ею (тогда энтропия системы уменьшается, S < 0), T — абсолютная температура.
Все изложенные выше наблюдения могут помочь второй закон термодинамики: в изолированной системе самопроизвольно протекающие процессы увеличивают энтропию системы. (На основании второго закона термодинамики возникла теория тепловой смерти Вселенной.)
Следствие из второго закона термодинамики – высокая степень упорядоченности в системе возможна при поступлении энергии и вещества из-за пределов системы.
Третий закон термодинамики устанавливает, что энтропия физической системы при стремлении температуры к абсолютному нулю не зависит от параметров системы и остается неизменной. (В формулировке М.Планка энтропия S = 0 при T = 0 К.)