
- •Вступ. Значення легованих сталей у сучасній техніці і промисловості
- •1. Легуючі елементи і домішки
- •1.1.Легування, мікролегування і модифікування
- •1.2 Маркірування сталей
- •1.3 Класифікація легуючих елементів по впливу на α- і γ-області
- •1.3.1. Легуючі елементи, що розширюють γ-область
- •1.3.2. Легуючі елементи, що звужують γ-область
- •1.4. Вплив легуючих елементів на критичні крапки сталі
- •1.4.1 Вплив на температуру евтектоідного перетворення
- •1.4.2 Вплив на концентрацію вуглецю в крапках s і e
- •2. Фази в легованих сталях
- •2.1. Карбідна фаза в легованій сталі
- •2.1.1. Умови карбидоутворення
- •2.1.2. Кількісний склад карбідної фази
- •2.1.3 Розчинні і нерозчинні карбіди
- •2.1.4 Дисперсійне твердіння
- •2.1.5 Вплив надлишкових карбідів
- •2.2. Тверді розчини в легованих сталях
- •2.2.1. Взаємна розчинність компонентів у сталі
- •2.2.2. Тверді розчини заміщення
- •2.2.3. Тверді розчини впровадження
- •2.3. Структура і властивості легованого фериту
- •2.4. Структура і властивості легованого аустеніту
- •2.4.1 Легування стабільного аустеніту
- •2.4.2. Легування метастабільного аустеніту
- •2.5 Термодинамічна активність вуглецю в залізі
2. Фази в легованих сталях
2.1. Карбідна фаза в легованій сталі
2.1.1. Умови карбидоутворення
Стосовно вуглецю легуючі елементи поділяються на три групи:
- графітизуючі елементи, не утворюючі карбіди і що знаходяться у твердому розчині (Si, Ni, Cu, Al);
- нейтральні елементи, що не утворюють карбіди і не викликають графітизацію
(Со);
- карбідоутворюючі елементи.
У сталях карбіди утворюються тільки металами, розташованими в періодичній системі Д.И. Менделєєва лівіше заліза.
Ці метали, як і залізо, відносяться до елементів перехідних груп, але мають менш добудований електроний d-рівень.
Як відомо з курсів фізики і хімії, електрони розташовані навколо ядра атома у виді окремих оболонок. Кожна оболонка розщеплюється на ряд рівнів: s, p, d, f На кожнім рівні розташовується обмежена кількість електронів. Наприклад, електронний d- рівень містить до 10 електронів. При збільшенні номера елемента електрони займають визначені місця по оболонках. Але є елементи, т.зв. елементи перехідних груп, у яких при добудованої зовнішній (валентної) оболонці залишаються вакантними місця на d- рівні попередньої оболонки. До перехідної групи відносяться багато металів.
У процесі карбидоутворення вуглець віддає свої валентні електрони на заповнення d-рівня. Утвориться металевий зв'язок, що визначає металеві властивості карбідів.
Чим лівіше в періодичній системі розташований елемент, тобто чим менш добудована в нього d-оболонка, тим більше стійким є карбід.
Звідси можна сформулювати умови карбідоутворення в сталях:
1. Карбідоутворюючими є тільки метали з електроним d-рівнем, заповненим менше, ніж у заліза.
2. Активність карбідоутворення тим вище і стійкість карбідів тим більше, ніж менш добудований d-рівень атома легуючого елемента.
Таким чином, при наявності декількох карбідоутворюючих елементів у першу чергу утворяться й в останню чергу розчиняються карбіди металів у наступній послідовності:
Fe→Mn→Cr→Mo→W→Nb→V→Zr→Ti
Кобальт і нікель можуть утворювати карбіди, але не в сплавах на залізній основі. Мідь, цинк і срібло мають заповнені d-рівні і карбідів не утворять.
По типу кристалічних грат усі карбіди поділяються на дві групи (фіг. 11).
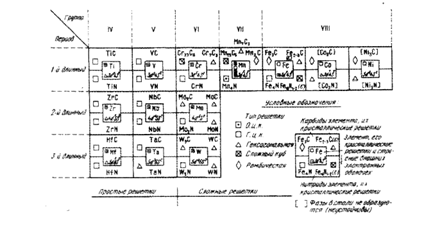
Фіг. 11. Структура перехідних металів, карбідів і нітридів,
утворених у сталях.
До
першої групи відносяться карбіди зі
складними кристалічними гратами, часто
з непостійним стехіометричним складом.
У гратах може знаходитися до сотні
атомів. До цієї групи відносяться карбіди
типів
 ,
,
 ,
,
 ,
,
де
,
,
де
 - сума карбідоутворюючих елементів,
наприклад
- сума карбідоутворюючих елементів,
наприклад
 ,
,
 .
.
Карбіди, утворені як фази впровадження, відносяться до другої групи.
Для всіх карбідоутворюючих елементів, крім Fe, Mn і Cr, відношення атомного радіусу вуглецю до атомного радіусу металу <0,59. З курсу металографії відомо, що при такому співвідношенні атомних радіусів можуть утворюватися фази впровадження.
Карбіди
цієї групи мають прості кристалографічні
грати і стехіометричний склад типу МС
або
 ,
наприклад
,
наприклад
 ,
VС,
WС.
,
VС,
WС.
Якщо проаналізувати зміну типу кристалічних грат карбідів металів у залежності від положення в періодичній системі Д.И.Менделєєва, то видно, що в міру заповнення d-рівня (ліворуч праворуч) типи кристалічних грат ускладнюються:
ІV-V групи - ГЦК (МС)
VI
група
-кубічна (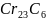 )
)
-гексагональна
( )
)
VII
група (Mn)
- кубічна ( )
)
-
гексагональна ( )
)
-ромбічна
( )
)
VIII
група (Fe)
- ромбічна ( )
)
-гексагональна
( ).
).
Складні карбіди VI-VII груп у сталі в чистому виді не зустрічаються, у тому числі і в вуглецевій сталі. У них частина атомів легуючих елементів заміщається атомами заліза і їх позначають як, наприклад, (Cr,Fе)2зС6.
Оцінити імовірність присутності того або іншого карбіду в сталі можна по відношенню атомних концентрацій легуючого елемента і вуглецю (М/С).
М/С |
Типи сталей |
|||
хромисті |
ванадієві |
вольфрамові |
молібденові |
|
<0,8 |
(Fe,Сr)3С |
(Fе,V)3С |
(Fе,W)3С |
(Fе,Мо)зС |
0,8-1,5 |
(Fe,Сr)3С + (Fe,Сr)7С3 |
VС |
Fе21W2С6 + (Fе,W)3С |
Fе21Мо2С6 + (Fе,Мо)3С |
1,5-2,5 |
(Сr,Fе)7Сз |
VС |
Fе21W2С6+ (Fe,W)С |
Fе2іМо2С6 + (Fе,Мо)С |
2,5-5,0 |
(Сr,Fе)7С3 + (Сr,Fе)23С6 |
VС |
(W,Fе)С |
(Fе,Мо)С |
>5,0 |
(Сr,Fе)23С6 |
VС |
(W,Fе)С + (W, Fe)2С |
(Fе,Мо)С + (Мо,Fе)2С |
Атомну концентрацію можна визначити по формулі:
(См/А)
Cат= ,
І (Смi / Аi)
де См і А - масова концентрація й атомна маса елемента;
Смi i Аi; - масова концентрація й атомна маса і-елемента.
Як було показано в минулих лекціях, у переважній більшості випадків карбидоутворюючі елементи зменшують граничну розчинність вуглецю в аустеніті до
змістів менш 2%. Тому эвтектика (ледебурит) утвориться вже в порівняно низковуглецевих сталях.
Наприклад, у системі Fе-Сr-С при 2% Сr евтектика з'являється при 1,3% С, а при 15% Сr-при 0,8% С. Однак, тому що зміст вуглецю в евтектиці низький, такі сплави пластичні, обробляються тиском при високих температурах навіть при наявності ледебуриту. Тому ці сплави називають не чавунами, а сталями ледебуритного класу.
