
- •1. Предмет технической термодинамики и ее задачи
- •2Основные параметры состояния газа
- •3. Законы идеальных газов. Уравнение состояния идеального газа
- •4. Газовые смеси
- •5. Эквивалентность теплоты и работы
- •6 Термодинам. Проц.
- •7 Внутренняя энергии газа
- •8 Работа Расширения
- •9 Определения. Истинная и средняя теплоемкость
- •10 Изобарная и изохорная теплоемкость идеального газа
- •11 Зависимость теплоемкости газов от температуры
- •12 Теплоёмкость смеси газов
- •13 Основные термодинамические процессы.
5. Эквивалентность теплоты и работы
Закон сохранения и превращения энергии устанавливает, что энергия не уничтожается и не создается вновь, а лишь переходит из одной формы в другую в различных физических» химических и других процессах. Переход энергии одного вида в другой происходит по закону эквивалентности, т. Е. определенному количеству энергии данного вида соответствует одно и то же количество энергии другого вида.
^Экспериментальное подтверждение закона сохранения энергии было получено <в работах русских и зарубежных ученых. В 1840 г. русский академик Г. Гесс впервые после М. В. Ломоносова сформулировал закон сохранения энергии применительно к термохимическим .процессам; в 1844 г. русский академик Р. Ленд установил количественное соотношение между электрической энергией и теплотой. Немецкий ученый Р. Майер, изучая тепловые процессы, теоретически вычислил механический эквивалент теплоты, положив в основу расчета значения теплоемкостей воздуха. Так как эти теплоемкости были весьма неточны, то и конечный результат, т. е. значение •механического эквивалента, значительно отличался от .истинного. Позднее на основе большого количества опытов с использованием различных веществ английский исследователь Д. Джоуль также определил механический эквивалент.
Эквивалентность между теплотой и работой выража-» ется уравнением:
Q=AL
L=EQ
В настоящее время значение механического эквивалента принимают равным
E=427 кгс*м/ккал
A=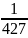 ккал/кгс*м
ккал/кгс*м
6 Термодинам. Проц.
Всякое изменение параметров состояния рабочего тела называется термодинамическим процессом. Каждый процесс совершается при тепловом и механическом взаимодействий рабочего тела с внешней окружающей средой, при этом_ состояние последней также изменяется. Термодинамический процесс, состоящий из непрерывного ряда равновесных состоянии, называется равновесным. Равенство давлений по всей массе газа характеризует его механическое равновесие, а равенство температур — термическое равновесие. Используя эти понятия, можно установить, что необходимым условием протекания равновесный Процессов Является существование механического и термического ривновесия Газа.
Избразим в p,v- диограмме произвольный равновесный процесс линией 1—2 (рис. 2-1). Из графика видно, что при переходе газа из начального 1 в конечное состояние 2 происходит понижение давления и увеличение удельного объема газау.Это есть процесс расширения газ а, который считается п р я м ы м процессом. Обратным процессом считается процесс сжатия газа, когда он из состояния 2 переходит в начальное состояние 1: при этом происходит уменьшение удельного объема и повышение давления.
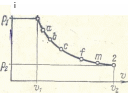
Характерным свойством равновесных процессов является их обратимость. В связи с этим равновесные процессы называются обратимыми цроцессами. Равновесные обратимые процессы являются идеальными процессами, которые в первую очередь рассматриваются термодинамикой. Все реальные: процессы протекаюл с большой скоростью и при наличии конечной разности температур и давлений между газом и 'внешней средой.; В связи с этим термическое и механическое равновесие газа не соблюдается, поэтому эти процессы будут неравновесными и, следовательно, необратимыми.
