
- •2. Основные понятия и определения технической термодинамики. Термодинамическая система. Рабочее тело, параметры состояния.
- •3. Уравнение состояния идеального газа. Универсальная газовая постоянная.
- •4. Газовые смеси. Способы задания, основные расчетные уравнения.
- •5. Теплоемкость. Соотношения между различными видами теплоемкостей.
- •6. Теплоемкость идеальных газов. Вывод формулы Майера.
- •7. Расчетные уравнения для вычисления работы изменения объема, работы вытеснения (проталкивания), внешней (располагаемой) работы. Pv – диаграмма.
- •8. Аналитические выражения первого закона термодинамики.
- •9. Внутренняя энергия рабочего тела. Вывод расчетного уравнения.
- •10. Энтальпия. Вывод расчетного уравнения. Hs- диаграмма.
- •11. Энтропия. Вывод расчетного уравнения. Ts- диаграмма
- •12. Термодинамические процессы идеальных газов, их изображение на pv, ts и hs- диаграммах.
- •13. Изобарный, изохорный и изотермический термодинамические процессы. Расчетные соотношения.
- •14. Адиабатный и политропный термодинамические процессы. Расчетные соотношения.
- •15. Второй закон термодинамики. Циклы теплового двигателя и холодильной машины. Термический кпд циклов.
- •16. Цикл Карно. Вывод уравнения для кпд цикла Карно
- •17. Двигатели внутреннего сгорания. Основные типы, методы классификации.
- •18. Карбюраторный двигатель. Вывод уравнения для кпд.
- •19. Дизельный двигатель. Вывод уравнения для кпд.
- •20. Газотурбинный двигатель. Устройство и принцип работы. Способы повышения кпд гту.
- •27. Паротурбинные установки. Цикл Ренкина, кпд и изображение на pv, ts и hs- диаграммах.
- •21. Одноступенчатый поршневой компрессор. Вывод уравнения для работы привода компрессора.
- •22. Многоступенчатый поршневой компрессор. Изображение процесса на pv и ts- диаграммах.
- •23. Реальные газы. Влажный воздух. Способы расчета термодинамических процессов реальных газов.
- •24. Водяной пар. Основные понятия и определения. Способы расчета термодинамических процессов.
- •25. 26 Изображение основных термодинамических процессов водяного пара на pv, ts и hs- диаграммах.
- •27. Паротурбинные установки. Цикл Ренкина, кпд и изображение на pv, ts и hs- диаграммах.
7. Расчетные уравнения для вычисления работы изменения объема, работы вытеснения (проталкивания), внешней (располагаемой) работы. Pv – диаграмма.
Работа в термодинамике, так же как и в механике, определяется и произведением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключенный в эластичную оболочку с поверхностью р
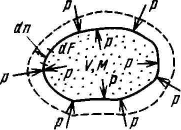
Если газу сообщить некоторое количество теплоты. то он будет расширяться, совершая при этом работу против внешнего давления р, оказываемого на него средой. Газ действует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn, совершает элементарную работу pdFdn. Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всеи поверхности F оболочки δL = p ∫F dFdn (1). Из рис. видно, что изменение объема dV выражается в виде интеграла по поверхности: dV = ∫F dFdn, следовательно, δL = pdV.
При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна L = v1∫v2 pdV. Из (1) следует, что δL и dV всегда имеют одинаковые знаки:
если с dV > 0, то и δL > 0, т. е. при расширении работа тела положительна, при этом тело само совершает работу;
если же dV < 0, то и δL < 0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне
Отнеся работу расширения к 1 кг массы рабочего тела, получим l = L / M, δl = δL / M = pdV/M = pd(V/M)= pdυ. Величина l, представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна
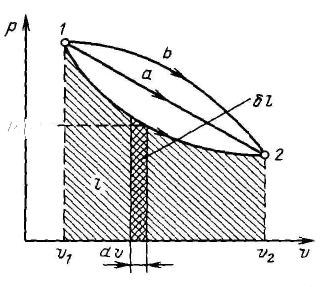
l = v1∫v2 pdυ
В термодинамике для исследования равновесных процессов широко используют р-v диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат — давление. Поскольку состояние термодинамической системы определяется двумя параметрами, то на р-v-диаграмме оно изображается точкой. На рис. 2 точка l соответствует начальному состоянию системы, точка 2 — конечному, а линия 12 — процессу расширения рабочего тела от υ1, до υ2.
8. Аналитические выражения первого закона термодинамики.
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям.
Он утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты δQ. В результате подвода теплоты тело нагревается на dТ и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на du. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу δL против сил внешнего давления. Так как никаких других изменении в системе не происходит, то по закону сохранения энергии δQ = du + δL, т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики.
Рассмотрим некоторые частные случаи.
1. δQ = 0 - теплообмен системы с окружающей средой отсутствует, т .е . теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется
а д и а б а т н ы м для него δL = - du. Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2. δL = 0— при этом объем тела не изменяется, dV = 0. Такой процесс называется изохорным, для него δQ = du,
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы.
3. du = 0 - внутренняя энергия системы не изменяется и
δQ = δL, т. е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
