- •[Ред.]Поширення в природі
- •[Ред.]у Всесвіті
- •[Ред.]у сонячній системі
- •[Ред.]На Землі
- •[Ред.]Фізичні властивості
- •[Ред.]Прозорість води
- •[Ред.]Хімічні властивості
- •[Ред.]Роль води в природі і житті
- •[Ред.]Шкодочинність та небезпека води
- •[Ред.]Вода у техніці
- •[Ред.]Якість води
- •[Ред.]Очищення природної води
- •[Ред.]Гідрологія
Розглянемо теоретичні та практичні аспекти теорії розчинів. Існують різні типи розчинів, але під істинними розчинами ми бу-демо розуміти гомогенну однофазну систему, яка складається з двох або більше компонентів. У теоретичних та практичних дослідженнях використовують дві теорії розчинів - фізичну теорію розчинів та хімічну теорію розчинів. Фізична теорія розчинів заснована на вивченні фізич-них характеристик розчинів. Базовим положенням цієї теорії є те, що поведінку молекул речовини у розчинах слід розглядати як поведінку молекул ідеального газу. Можливі відхилення у пове-дінці молекул реальної речовини від поведінки молекул ідеально-го газу треба розглядати з позицій електролітичної дисоціації. Хімічна теорія розчинів була розроблена Д.І. Менделєєвим. Цю теорію також називають сольватною теорією розчинів. Згі-дно цієї теорії, в процесі розчинення речовини відбувається хімі-чна взаємодія, яка супроводжується утворенням сольватів. Прик-ладом реакції утворення сольватів є розчинення мідного купоро-су: CuS04 + 5Н20 = CuS04 ■ 5Н20 . Процес утворення розчинів можна проаналізувати з позицій обов'язкового виконання двох умов: термодинамічних та кінети-чних умов. 3 позиції термодинамічних умов процес розчинення слід розглядати як довільний, виконується умова AG < 0; якщо розчин насичений, mo AG = 0; якщо пересичений - TO AG > 0. Розглянемо деякі найбільш суттєві моменти практичного ви-користання основних положень теорії розчинів. При проведенні фізико-хімічних досліджень залежно від завдань експерименту суттєвим моментом є знання складу взаємодіючих об'єктів - їх концентрацій. Існують декілька способів вираження концентра-цій взаємодіючих речовин. Експериментатор залежно від очіку-ваних результатів, методів опрацювання експериментальних да-них та використовуваного обладнання може застосувати такі спо-соби: - у масових частках ; 7=молярна концентрація С\, — —V де ПІ - кількість молів /-го компонента в об'ємі розчину V = 10 м ; - еквівалентна молярна концентрація Е. V де Et - кількість еквівалентів розчиненої речовини в об'ємі розчину V = 10 м ; - молярність - кількість речовини, розчиненої в 1000 мл розчинника; - молярна частка пі і £ п I /-X де К - кількість компонентів у розчині; для двокомпонентної системи має місце співвідношення X А + Хв = 1; X А = 1 - Хв - розбавлення (розведення) - це кількість молів розчинника, що приходиться на 1 моль розчиненоїречовини п Vi пі - розчинність - максимальна кількість грамів (молів), яка може бути розчинена у 100 г розчинника при певній температурі. Існують також декілька способів розподілу розчинів на типи. Наприклад, існують тверді розчини (сплави), рідинні (вода-спирт) та газоподібні (повітря). Розчини можна також розрізняти за здатністю компонентів змішуватися: - розчинена речовина та розчинник змішуються необме-жено; - розчинена речовина та розчинник змішуються обмеже-но; - розчинена речовина та розчинник не змішуються. Таким чином, розчинність як процес у фізико-хімічних дос-лідженнях є одним з найбільш важливих параметрів, який харак-теризує конкретну речовину. Розчинність залежить від багатьох факторів, але експериментально встановлена певна загальна за-кономірність: подібне добре розчиняється у подібному. Характе-рним є також те, що розчинність твердих речовин залежить від температури; характер цієї залежності неоднозначний. Так, на-приклад, розчинність KN03 з підвищенням температури зростає, а розчинність (СН3СОО)2Са - зменшується. Для усіх газів харак-терним є зниження розчинності з підвищенням температури. Для газів характерним є те, що, на відміну від твердих та рі-динних речовин, їх розчинність залежить від тиску: підвищення тиску збільшує розчинність газів. Це відповідає принципу Ле-Шательє, про який ми згадували вище. Закономірності розчинності більшості газів у рідинах в обла-сті помірних тисків вивчав Генрі; він сформулював емпіричний закон, який пов'язує розчинність газів у рідинах із зовнішнім ти-ском. При постійний температурі розчинність газів у рідинах лі-нійно зростає із зростанням тиску: ХА = К-рА, (8.1) де К - константа Генрі; хг ірг -молярна частка та тиск газу відповідно. Як бачимо, фізичний зміст константи Генрі полягає у насту-пному. Константа Генрі - це фізична величина, яка чисельно дорі-внює зміні молярної частки розчиненого газу при зміні його ти-ску на одиницю. Розвиваючи роботи Генрі про розчинність газів у різноманіт-них рідинних середовищах, Сєченов вивів правило, яке дозволяє якісно оцінити вплив деяких факторів на розчинність газів у рі-динах. Розчинність газів та неполярних речовин у рідинах змен-шується, якщо додати до розчину електроліт. У фізико-хімічній літературі (у теорії розчинів) ця закономі-рність отримала назву правила Сєченова. Джерело: http://ebooktime.net/book_201_glava_51_8.1._%D0%A2%D0%B8%D0%BF%D0%B8_%D1%80%D0%BE%D0%B7%D1%87%D0%B8%D0%BD%D1%96%D0%B2.html
Карбо́н (С) або вугле́ць — хімічний елемент з атомним номером 6. Позначається С, належить до поширених елементів земної кори, складаючи близько 0,1% її маси. Сполуки вуглецю є основою всіхрослинних і тваринних організмів.
Зміст [сховати]
|
[ред.]Загальна характеристика
За звичайних умов вуглець хімічно інертний, при високих температурах сполучається з багатьма елементами, виявляючи сильні відновні властивості. Найважливіша властивість вуглецю - здатність його атомів утворювати міцні хімічні зв'язки як між собою, так і з іншими елементами. Здатність вуглецю утворювати 4 рівнозначні валентні зв'язки з іншими атомами дозволяє будувати вуглецеві скелети різних типів (лінійні, розгалужені, циклічні); саме цими властивостями і пояснюється виняткова роль вуглецю в будові органічних сполук і, зокрема, всіх живих організмів.
[ред.]Фізичні властивості
[ред.]Алотропні видозміни
Вуглець утворює декілька алотропних видозмін:
природні:
алмаз
графіт
лонсдейліт
фулерен
вуглецеві нанотрубки
штучні:
карбін,
графен
аморфний вуглець у вигляді сажі і деревного вугілля.
[ред.]Алмаз
Детальніше: Алмаз
Прозора та безбарвна або трохи забарвлена домішками в різноманітні відтінки кристалічна речовина. Він яскраво блищить внаслідок сильного заломлення проміння.
Алмаз — найтвердіша речовина серед усіх відомих. Завдяки своїй надзвичайній твердості він широко застосовується при бурінні твердих гірських порід, обробці твердих металів і їх сплавів тощо. Відшліфовані безбарвні кристали алмазу —діаманти — коштовні прикраси.
Найбільші родовища алмазів розташовано в Південній Африці та в Якутії. Щорічний світовий видобуток алмазу становить приблизно 300 кг. В останні роки алмаз почали одержувати штучно при дуже високих тисках і високій температурі.
[ред.]Графіт
Детальніше: Графіт
Темно-сіра непрозора дрібнокристалічна речовина, жирна на дотик. На відміну від алмазу графіт добре проводить електричний струм і тепло і дуже м'який. Графіт у великих кількостях одержують штучно — нагріванням коксу або антрациту в спеціальних електричних печах при температурі близько 3000°С і підвищеному тиску без доступу повітря. Штучний графіт відзначається високою чистотою і м'якістю. За своїми якостями він кращий за природний. Графіт широко застосовується для виготовлення електродів, в суміші з глиною для виробництва вогнетривких тиглів. З графіту роблять звичайні олівці. В суміші з мінеральним маслом його використовують як мастило для машин, що працюють при підвищених температурах.
Різка відмінність у фізичних властивостях алмазу і графіту обумовлюється їх різною кристалічною будовою. В кристалах алмазу кожний атом вуглецю оточений чотирма іншими атомами, розміщеними на однаковій віддалі один від одного. В кристалах графіту атоми вуглецю розміщені у кутах правильних шестикутників в одній площині і утворюють окремі шари. Віддаль між окремими шарами більша, ніж між атомами в тому ж шарі. Внаслідок цього зв'язок між окремими шарами значно слабший, ніж між атомами того ж шару. Тому кристали графіту легко розщеплюються на окремі лусочки, які самі по собі досить міцні.
[ред.]Графен
Детальніше: Графен
Графен за своєю будовою - окремий атомний шар у структурі графіту — атоми вуглецю утворюють стільникову структуру з міжатомною віддаллю 142 пм. Без опори графен має тенденцію згортатися, але може бути стійким на підкладинці.
[ред.]Карбін
Детальніше: Карбін
Штучно отриманий різновид вуглецю, який являє собою дрібнокристалічний порошок чорного кольору, кристалічна структура характеризується наявністю довгих ланцюжків атомів вуглецю, розташованих паралельно. Густина 3,23-3,30.
[ред.]Фулерен
Детальніше: Фулерен
Специфічна вуглецева структура, молекула якої має вигляд м'яча. Внутрішня частина молекули пуста, що обумовлює широкі можливості для одержання на основі фулерену сполук включення.

![]()
Фулерени C60 Кристали
[ред.]Вуглецеві нанотрубки
Детальніше: Вуглецеві нанотрубки
Специфічна вуглецева структура, в якій атоми вуглецю утворюють поверхню, що "скручена" в трубку нанорозмірів. Має унікальні фізичні властивості, зокрема міцність на розрив, адсорбційну здатність. Активно досліджується і має великі перспективи для використання. Вуглецеві нанотрубки виявлені у природі (шунгіт) і одержано штучно.
[ред.]Аморфний вуглець
Стан вуглецю з неврегульованою структурою - (сажа, кокс, деревне вугілля). У природі не зустрічається. Його одержують штучно з різних сполук, що містять вуглець. Аморфний вуглець, або просто аморфне вугілля, насправді є кристалічним, але його кристалики такі малі, що їх не видно навіть у мікроскоп. Фізичні властивості “аморфного" вуглецю значною мірою залежать від дисперсності частинок та від наявності домішок.
Найважливішими технічними сортами аморфного вуглецю є сажа і деревне вугілля. Сажа являє собою найчистіший аморфний вуглець. У промисловості сажу одержують здебільшого термічним розкладом метану, а також при спалюванні різних органічних речовин при недостатньому доступі повітря. Сажу широко застосовують як наповнювач у виробництві гуми з каучуку, а також для виготовлення друкарських фарб, туші тощо.
Деревне вугілля добувають нагріванням дерева без доступу повітря у спеціальних печах. Його застосовують у металургії для одержання високих сортів чавуну і сталі, в ковальській справі, для виготовлення чорного пороху і як адсорбент.
[ред.]Лонсдейліт
Лонсдейліт виявлено у метеоритах і отримано штучно; його структура та фізичні властивості остаточно не встановлено.
[ред.]Хімічні властивості
Хімічна активність різних алотропних видозмін вуглецю різна. Алмаз і графіт майже не вступають в хімічні реакції. Вони можуть реагувати лише з чистим киснем і тільки за дуже високої температури.
Аморфний вуглець а також вугілля за звичайної температури досить інертні, але при сильному нагріванні їх активність різко зростає і вуглець безпосередньо сполучається з багатьма елементами. Так, при нагріванні на повітрі вугілля горить, утворюючи діоксид вуглецю:
C + O2 = CO2
При недостатньому доступі кисню повітря він частково згоряє до монооксиду вуглецю CO, в якому вуглець двовалентний:
2C + O2 = 2CO
Коли через розжарене вугілля пропускати пари сірки, то утворюється сірковуглець:
C + 2S = CS2
При високій температурі вугілля досить сильний відновник. Воно віднімає кисень від оксидів багатьох металів. Наприклад:
2CuO + C = 2Cu + CO2↑
Через цю здатність, вугілля широко застосовують у металургії для добування металів із руд.
Ступені окислення +4, −4, рідко +2 (З, карбіди металів), +3 (C2N2, галогенциани); спорідненість до електрона 1,27 еВ; енергія іонізаціїпри послідовному переході від С0 до С4+ відповідно 11,2604, 24,383, 47,871 і 64,19 еВ.
[ред.]Органічні сполуки
Детальніше: Органічна хімія
Завдяки здатності вуглецю утворювати полімерні ланцюжки, існує величезний клас з'єднань на основі вуглецю, яких значно більше, ніж неорганічних. Найбільші групи: вуглеводні, білки, жири та ін.
[ред.]Розповсюдження
Вуглець у природі зустрічається як у вільному стані (алмаз, графіт, карбін і лонсдейліт, фулерен, вуглецеві нанотрубки), так і у вигляді різноманітних сполук. Середній вміст вуглецю у земній корі 2,3×10-2 % (мас); основна маса вуглецю концентрується в осадових гірських породах. Вуглець накопичується у верхній частині земної кори, де його присутність пов'язана в основному з живою речовиною, кам'яним вугіллям, нафтою, антрацитом, а також з доломітами і вапняками. Відомо понад 100 мінералів вуглецю, серед яких найбільш поширені карбонати кальцію, магнію і заліза. Він входить до складу кам'яного вугілля, нафти і природного газу, а також різних мінералів: мармуру, крейди і вапняку — CaCO3, доломіту — CaCO3·MgCO3, магнезиту — MgCO3, малахіту — CuCO3·Cu(OH)2тощо.
Важливу роль вуглець відіграє в космосі; на Сонці вуглець посідає 4-е місце за поширеністю після водню, гелію та кисню, ядра вуглецю беруть участь у процесах нуклеосинтезу (вуглецево-азотний цикл, потрійна α-реакція).
[ред.]Біологічна роль
Сполуки вуглецю є основою всіх рослинних і тваринних організмів.
[ред.]Застосування
Деревне вугілля має здатність адсорбувати (поглинати) на своїй поверхні різні гази і деякі речовини з розчинів. Адсорбція відбувається поверхнею вугілля, тому воно здатне поглинати (адсорбувати) тим більшу кількість речовин, чим більша його сумарна поверхня, тобто чим більше воно подрібнене або пористе. Пористість, а разом з тим і адсорбційна здатність деревного вугілля різко збільшується при попередньому нагріванні в струмені водяної пари. При цьому пори вугілля очищаються від смолистих речовин і його внутрішня поверхня дуже збільшується. Таке вугілля називається активованим.
Активоване деревне вугілля широко використовують у цукровому виробництві для очистки цукрового сиропу від домішок, що надають йому жовтого забарвлення, в спиртовому виробництві для очистки винного спирту від сивушних масел, в деяких виробництвах для вловлювання парів цінних летких речовин — бензину, ефіру, сірковуглецю, бензолу тощо з наступним видаленням їх при нагріванні.
У першу світову війну активоване вугілля за пропозицією академіка М. Д. Зелінського було застосовано в протигазах для захисту органів дихання від отруйних газів, зокрема від хлору, який німці застосували в 1915 р. проти французьких військ. Активоване вугілля як адсорбент застосовується і в сучасних протигазах
Атом - мікрочастинка, яка складається з ядра, що вміщує протони і нейтрони, і електронів, які утворюють зовнішню оболонку Хімічний елемент - вид атомів з однаковим зарядом ядра Ізотоп - вид атомів з однаковим масовим числом Масове число - загальна кількість протонів і нейтронів, що входять до ядра |
Квантові числа - параметри, що визначають електронну структуру і властивості електронів атома n - головне квантове число; визначає енергетичний рівень і енергію електрона n = 1, 2, ...[1]... ; l - орбітальне квантове число; визначає енергетичний підрівень, форму орбіталі і енергію електрона l = 0, 1, ...[1]... n-1; ml - магнітне квантове число; визначає просторову орієнтацію атомних орбіталей ml = -1... [1]...+1; ms - спінове квантове число; визначає власний механічний і магнітний момент електрона ms = -1/2 або +1/2 Кількість енергетичних підрівнів на енергетичному рівні дорівнює n Електронна ємність енергетичного рівня дорівнює 2n2 Кількість орбіталей на енергетичному підрівні дорівнює 2l + 1 Електронна ємність енергетичного підрівня дорівнює 2·(2l + 1) |
Принцип Паулі - в атомі не може бути двох або більше електронів з однаковим набором всіх чотирьох квантових чисел Правило Гунда - сумарне спінове число електронів на даному підрівні повинне бути максимальним Правило Клечковського - енергетичні підрівні заповнюються у порядку зростання величиниn+l, а при рівних значеннях - у порядку зростання величини n. |
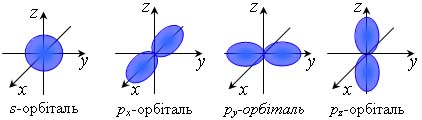
Форма і просторова орієнтація s- і p-орбіталей
|
Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине.
Зако́н Гей-Люсса́ка — назва двох законів, що описують властивості газів.
1) Закон теплового розширення газів: при сталому тискові залежність об'єму Vt даної маси газу від температури описується формулою:
Vt/T = const
або
Vt=V0(1+ αt),
де V0 — об'єм газу при даному тискові і при температурі 273,15 К; t — температура (емпірична) за шкалою Цельсія; Т —термодинамічна температура; α — коефіцієнт об'ємного розширення газу (для інертних газів, водню і кисню а дорівнює коефіцієнту об'ємного розширення ідеального газу α = 1/(273.15 К)).
2) Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Наприклад, при взаємодії одного об'єму водню з одним об'ємомхлору утворюється два об'єми хлористого водню.
Закон носить ім'я французького вченого Жозефа-Луї Гей-Люссака.
Джон Дальто́н (*6 вересня 1766 — †27 червня 1844) — англійський хімік і фізик, відомий теорією корпускулярної будови матерії та дослідженнями кольорової сліпоти (дальтонізму). .
Він виходив з уявлення про корпускулярну будову матерії, але, засновуючись на поняттіхімічних елементів Лавуаз'є, вважав, що «атоми» (цей термін Дальтон зберіг як данину поваги до Демокрита) даного елемента однакові і характеризуються крім інших властивостей тим, що мають певну вагу, яку він назвав атомною. Дальтон виявив, що два елементи можуть сполучатися один з одним в різних співвідношеннях, і кожна нова комбінація елементів дає нову сполуку. У 1803 ці результати були узагальнені у виглядізакону кратних відношень. У 1808 вийшла праця Дальтона Нова система хімічної філософії, де він детально виклав свою атомну теорію. У тому ж році французький хімікЖозеф Луї Люссак (1778 — 1850) опублікував припущення про те, що об'єми газів, які вступають у реакцію один з одним, відносяться між собою як прості кратні числа. На жаль, Дальтон не зумів побачити користі у відкритті Люссака, крім перешкоди для розробки своєї теорії, хоч ці висновки могли б стати дуже плідними у визначенні відносної атомної ваги.
Від імені цього вченого хіміка пішло поняття дальтонізм, яким до кінця життя страждав Джон Дальтон.
Оксиген і сульфур
Загальна характеристика оксигену і сульфуру
Оксиген і Сульфур – елементи Vш групи періодичної системи, належать до головної підгрупи.
Електронна будова. Що ж видно з електронних формул Оксигену 1s22s22p4 і Сульфуру 1s22s22p63s23p4.
Поняття про алотропію. Озон.
Хімічні елементи у вільному стані існують у формі простих речовин. Так, елемент Оксиген утворює дві прості речовини – кисень О2 та озон О3.
Озон. Якщо на кисень подіяти електричним розрядом, то з'являється характерний запах свіжості – утворюється газоподібний озон:
Кисень поглинає енергію і перетворюється на озон, а озон самовільно розкладається, утворюючи кисень.
Обидві прості речовини – кисень О2 і озон О3 – утворені одним і тим самим хімічним елементом – Оксигеном, а властивості у них різні.
Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а самі прості речовини – алотропними формами (модифікаціями).
Властивості кисню й озону.
Властивості простих речовин |
Прості речовини |
|
кисень |
озон |
|
Агрегатний стан за стандартних умов |
Газ |
Газ |
Колір |
Безбарвний |
Синій |
Запах |
Без запаху |
Різкий, своєрідний |
Розчинність (у 100 об’ємах Н2О при 200С) |
3 об’єми |
49 об’ємів |
Густина газу за н.у. |
1,43 г/л |
2,14 г/л |
Температура кипіння |
-1930С |
-1120С |
Температура плавлення |
-2190С |
-1920С |
Фізіологічна дія |
Неотруйна |
Дуже отруйний |
Хімічні властивості |
Окисник |
Дуже сильний окисник |
Реакційна здатність |
Висока |
Дуже висока |
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральний масел; як дезинфікуючий засіб у медицині; як окисник ракетного палива.
Проте буває й інша причина алотропії – різна структура кристалів. З таким типом алотропії ви ознайомитися на прикладі сірки.
Сірка за стандартних умов – крихка кристалічна речовина жовтого кольору. Погано проводить теплоту і не проводить електричного струму. У воді не розчиняється краще розчиняється в деяких розчинниках (у сірковуглеці CS2, бензині, етері та ін.).
І в розчинах, і в кристалах сірка складається з циклічних молекул S8, які за формою нагадують корону. Але в кристалах ці молекули можуть бути упаковані по-різному.
Якщо молекули розташовані щільно, утворюється алотропна форма ромбічна сірка. Менш щільне упакування молекул спричинює виникнення іншої алотропної форми – моноклінної сірки.
Якщо сірку розплавити і швидко охолодити, утворюється ще одна алотропна форма: пластична сірка – коричнева губоподібна маса.
Властивості ромбічної і моноклінної сірки
Властивості простих речовин |
Сірка |
|
ромбічна |
моноклінна |
|
Колір |
Лимонно-жовтий |
Блідо-жовтий, майже безбарвний |
Густина |
2,07 г/л |
1,96 г/л |
Температура плавлення |
112,80С |
119,30С |
Вода, Н2O — прозора рідина без запаху, смаку і кольору; оксид водню. Молекула води складається з одного атома оксигену і двох атомів гідрогену. Атоми гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів гідрогену (протонів) на атоми дейтерію утворюється модифікація, яка називається важкою водою.
Зміст [сховати]
|
[Ред.]Поширення в природі

Краплини води (роса) на павутинці
[Ред.]у Всесвіті
Хімічні елементи, які входять до складу води, Гідроген іОксиген, належать до найбільш поширених у природі. Утворення води з цих елементів відбувається там, де густина газів достатньо велика і зіткненням між атомами достатньо ймовірне. Вода виявлена в складі міжзоряних газових хмар, що лежать у межах нашої галактикиЧумацького Шляху.
[Ред.]у сонячній системі
Одним з найбільш важливих питань, пов'язаних з освоєнням космосу людиною і можливісттю виникнення життя на інших планетах, є питання про наявність води за межами Землі в досить великій концентрації. Відомо, що деякі комети більш, ніж на 50% складаються з водяного льоду. Не варто, втім, забувати, що не будь-яке водне середовище придатне для життя - зокрема, акумуляторна батарея містить 25% розчинсірчаної кислоти у воді (але життя в ньому, очевидно, є маловірогідним, тим більше, його виникнення).
У результаті бомбардування місячного кратера, проведеного 9 жовтня 2009 року НАСА з використанням космічного апарату LCROSS, вперше були отримані достовірні свідчення наявності на супутнику Землі водяного льоду у великих обсягах. [1]
Точно з*ясовано, що вода у замерзлому стані є на поверхні Марсу.
Рідка вода, імовірно, є під поверхнею деяких супутників планет, найбільш ймовірно, на Європі, супутнику Юпітера.
[Ред.]На Землі
Вода належить до найбільш поширених речовин на Земній кулі[Джерело?]. Водою вкрито близько 4/5 поверхні земної кулі (океани,моря, озера, річки). Значна її кількість у вигляді льоду і снігу вкриває високі гори і величезні простори Арктики і Антарктиди. Багато води в атмосфері — пара, туман і хмари. Значні кількості води містяться і в земній корі у вигляді підземних вод. У природі вода перебуває не тільки у вільному стані, а і в хімічно зв'язаному.
Вода входить до складу багатьох гірських порід і всіх рослинних і тваринних організмів. На воду припадає близько 60 % маси тварин і до 80 % маси риб. У деяких рослинах вміст води іноді перевищує 90 % їхньої маси.
Більшість запасів води на Землі знаходяться в морях і океанах, прісна вода становить менше 1 %.
[Ред.]Фізичні властивості
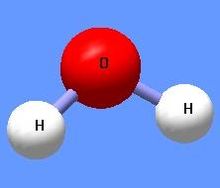
Спрощена модель структури молекули води
Чиста вода - безбарвна прозора рідина, без запаху і смаку. За нормального атмосферного тиску при 0°С вона замерзає і перетворюється у лід, а при 100°С - кипить, перетворюючись упару. У газоподібному стані вода існує і за нижчої температури, навіть нижче 0°С. Тому лід і сніг теж поступово випаровуються.
У рідкому стані вода практично не стискається, при замерзанні розширюється на 1/11 від свого об'єму.
Найбільшу густину вода має при +4°С. Масу 1 см3 чистої води при цій температурі прийняли за одиницю і назвали грамом (сучасне визначення грама основане на точнішому еталоні). На відміну від інших рідин, вода при охолодженні від + 4 до 0°С розширюється. Тому лід легший від води (на 8%) і не тоне у ній. Завдяки цьому, а також малій теплопровідності шар льоду захищає глибокі водойми від промерзання до дна, і цим забезпечується у них життя.
Потрійна точка води, тобто умови, за яких одночасно у рівноважному стані можуть співіснувати вода, лід та пара, реалізується при температурі 0,01 °C і тиску 611,73 Па. Значення 0,01 °C точне — на ньому основане визначення одиниці вимірювання температури в Міжнародній системі (СІ), кельвіна.
Вода характеризується великою питомою теплоємністю, що дорівнює за означенням калорії 1 кал/г-град. Завдяки цьому температура океанів і морів змінюється досить повільно, і цим регулюється температура на поверхні земної кори. Цим пояснюється також те, щоклімат на островах рівномірніший, ніж на материках.
Фізичні властивості води великою мірою зумовлені тим, що молекула води має значний дипольний момент (1,844 Дебая). Завдяки цьому молекули води сильно взаємодіють між собою, що приводить до конденсації при доволі високій температурі. Так, наприклад, набагато важчі молекули кисню і вуглекислого газу при цих температурах конденсованої фази не утворюють. Легкі атоми водню утворюють водневі зв'язки між різними молекулами, зумовлюючи складну взаємозв'язану структуру рідини.