
- •1.1Основы хим. Термодинамики:система,термодинамические параметры,термодинамические функции,1- ый закон термодинамики.
- •2.Энергетика химических процессов(энтальпия,внутренняя энергия)
- •4.Энтропия. Уравнение Больцмана.2 и 3 закон термодинамики.
- •5.Энергия Гиббса. Направление протекания химических процессов.
- •2.Химическая кинетика.
- •1.Скорость хим. Реакции. Средняя и истинная скорость реакции. График зависимости.
- •2.Влияние температуры на скорость реакции. Правило Вантгофа.
- •3.Влияние концентрации на скорость химической реакции. Закон действия масс.
- •4.Энергия активации. Активированный комплекс. Уравнение Аррениуса.
- •5.Гомогенный,гетерогенный катализ.
- •6.Колебательные реакции.
- •7.Химическое равновесие. Const химич-го равновесия.
- •8.Смещение химического равновесия. Принцип Ле-Шателье.
- •3.Растворы.
- •1.Способы выражения концентрации растворов.
- •2.Степень и const электролитической диссоциации.Закон разбавления Оствальда.
- •3.Диссоциация солей,кислот,оснований,амфотерных гидроксидов.
- •4.Произведение растворимости.
- •5.Диссоциация воды. Рн. Ионное произведение воды.
- •6.Гидролиз солей,степень и константа гидролиза.
3.Растворы.
1.Способы выражения концентрации растворов.
Концентрация-физическая величина,показывающая содержание растворённого вещества в определённом количестве раствора. Концентрация может выражаться:1)массовая доля растворённого вещества. 2)молярная концентрация. 3) моляльная концентрация. 4) молярная концентрация эквивалента вещества. 5)Титр вещества. 6)моляльная доля вещества.
1)-безразмерная величина равная отношению массы растворенного вещества к массе растворителя W(В)=n*M/m(р-ра).
2)-величина,показывающая сколько молей растворенного вещества содержится в одном литре раствора. Cm(В)=n(В)/V(р-ра)
3)-показывает какое количество вещества содержится в одном кг. Растворителя. Cm=n(B)/m(р-ля).
4)величина,показывающая количество эквивалентов растворенного вещества,содержащихся в одном литре раствора. Ch=n(экв)/V(р-ра).
5)величина показывающая массу вещества,содержащегося в 1 мл раствора. T=m(B)/V(р-ра).
6)величина показывающая отношение количества растворенного вещества к общему количеству всех веществ в растворе. N(B)=n(B)/n(B)+n(р-ля).
2.Степень и const электролитической диссоциации.Закон разбавления Оствальда.
Электролитическая диссоциация-процесс распада электролита на ионы при растворении в воде,или расплавлении.
α(степень диссоциации)-величина,показывающая какая часть молекул распалась на ионы от общего числа растворенных молекул.
α=(n/N)*100%.
Закон разбавления Оствальда-С уменьшением концентрации электролита степень диссоциации электролита повышается.
Константа электролитической диссоциации-Константа диссоциации Кд характеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.
В общем виде для процесса электролитической диссоциации, выражаемого уравнением:
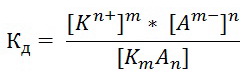
3.Диссоциация солей,кислот,оснований,амфотерных гидроксидов.
1.Диссоциация кислот-. Диссоциация кислот идет с образованием катиона водорода и анионов кислотного остатка:НСl<=> Н+ + Сl-.
Кислотные остатки могут быть различными, а ион водорода образуется при диссоциации всех кислот.
2.Диссоциация оснований-При диссоциации оснований образуются катионы металла и общие для всех оснований анионы гидроксида ОН-:
K0H<=>K+ + OH--.Таким образом, основания можно определить как соединения, дающие в водном растворе ионы гидроксида.
3.Диссоциация амфотерных гидроксидов- диссоциация таких молекул может происходить как по типу кислоты, так и по типу основания.
Н+ + МеO- <=> МеОН <=> Ме+ + OH-
4.Диссоциация солей-Соли при диссоциации образуют катионы металла и анионы кислотного остатка:
NaN03 <=> Na+ + N03-. Ионов, которые были бы общими для водных растворов всех солей, нет, поэтому соли не обладают общими свойствами.
При растворении кислых солей в растворе образуются катионы металла и сложные ионы кислотного остатка, которые в свою очередь подвергаются диссоциации с образованием ионов Н+:
