
- •1.1Основы хим. Термодинамики:система,термодинамические параметры,термодинамические функции,1- ый закон термодинамики.
- •2.Энергетика химических процессов(энтальпия,внутренняя энергия)
- •4.Энтропия. Уравнение Больцмана.2 и 3 закон термодинамики.
- •5.Энергия Гиббса. Направление протекания химических процессов.
- •2.Химическая кинетика.
- •1.Скорость хим. Реакции. Средняя и истинная скорость реакции. График зависимости.
- •2.Влияние температуры на скорость реакции. Правило Вантгофа.
- •3.Влияние концентрации на скорость химической реакции. Закон действия масс.
- •4.Энергия активации. Активированный комплекс. Уравнение Аррениуса.
- •5.Гомогенный,гетерогенный катализ.
- •6.Колебательные реакции.
- •7.Химическое равновесие. Const химич-го равновесия.
- •8.Смещение химического равновесия. Принцип Ле-Шателье.
- •3.Растворы.
- •1.Способы выражения концентрации растворов.
- •2.Степень и const электролитической диссоциации.Закон разбавления Оствальда.
- •3.Диссоциация солей,кислот,оснований,амфотерных гидроксидов.
- •4.Произведение растворимости.
- •5.Диссоциация воды. Рн. Ионное произведение воды.
- •6.Гидролиз солей,степень и константа гидролиза.
2.Химическая кинетика.
1.Скорость хим. Реакции. Средняя и истинная скорость реакции. График зависимости.
Скорость химической реакции нужно различать между гетерогенными т гомогенными реакциями.
Скорость гомогенной определяется изменением концентрации одного из веществ в единицу времени. υ=+-ΔС\ΔϮ.
Скорость гетерогенной реакции определяется изменением количества вещества в единицу времени на единицу поверхности раздела фаз.
υ=+-Δn/ΔϮ*S.
Средняя и истинная скорость реакции.
2.Влияние температуры на скорость реакции. Правило Вантгофа.
С увеличением температуры, скорость большинства реакций увеличивается. Зависимость скорости от температуры выражается правилом Вантгофа:При увеличении температуры на каждые 10 градусрв,скорость реакции увеличивается в 2-4 раза.
Зависимость скорости от температуры можно объяснить при помощи двух теорий:1) теория активных столкновений.
2)переходного состояния.
1.Увеличение скорости при увеличении температуры объясняется тем,что вещества должны сталкиваться,но не каждое приводит к продукту реакции. Аррениус высказывал предположение,что столкновение частиц может приводить только в том случае,если энергия столкновения частиц равна или больше энергии активации. Чем меньше энергия активации,тем выше скорость реакции.
Согласно 2 теории,в процессе химической реакции,связи в активных частицах ослабевают и возникают новые связи. Переходное состояние,в котором старые связи ещё не разрушены, а новые ещё не образованы характеризуется max энергией активации. Если энергия активации <40 кДЖ\моль,то реакция протекает с очень большой скоростью. Если 40<энер.актив.<120,то со средней скоростью. Если энер.актив.>120,то с очень маленькой скоростью.
3.Влияние концентрации на скорость химической реакции. Закон действия масс.
Влияние концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции, протекающей в однородной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Например, для обратимой гомогенной реакции, выражающейся уравнением aA + bB ↔ cC + dD, в соответствии с законом действия масс, можно записать выражение скорости прямой и обратной реакций:
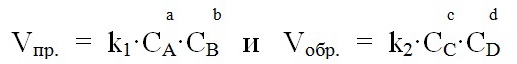
где k1 и k2 – константы скоростей прямой и обратной реакций.
Физический смысл константы скорости заключается в том, что она показывает численное значение скорости химической реакции, с которой реагируют вещества при их концентрации (или произведении концентраций), равной единице. Константа скорости реакции зависит от природы реагентов, температуры, наличия катализатора, но не зависит от концентрации реагентов.
4.Энергия активации. Активированный комплекс. Уравнение Аррениуса.
Аррениус ввел в обиход химиков очень важное понятие энергии активации (Ea) – это та минимальная энергия, которой должна обладать молекула (или пара реагирующих молекул), чтобы вступить в химическую реакцию. Энергию активации измеряют обычно в джоулях и относят не к одной молекуле (это очень маленькая величина), а к молю вещества и выражают в единицах Дж/моль или кДж/моль. Если энергия сталкивающихся молекул меньше энергии активации, то реакция не пойдет, а если равна или больше, то молекулы прореагируют.
Активированный комплекс-группировка атомов в решающий момент элементарного акта хим. реакции.
![]()
Уравнение Аррениуса-
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. т-ра, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу, а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в Аррениуса уравнении величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график)-прямая линия, отрицат. наклон к-рой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
