
- •1.1Основы хим. Термодинамики:система,термодинамические параметры,термодинамические функции,1- ый закон термодинамики.
- •2.Энергетика химических процессов(энтальпия,внутренняя энергия)
- •4.Энтропия. Уравнение Больцмана.2 и 3 закон термодинамики.
- •5.Энергия Гиббса. Направление протекания химических процессов.
- •2.Химическая кинетика.
- •1.Скорость хим. Реакции. Средняя и истинная скорость реакции. График зависимости.
- •2.Влияние температуры на скорость реакции. Правило Вантгофа.
- •3.Влияние концентрации на скорость химической реакции. Закон действия масс.
- •4.Энергия активации. Активированный комплекс. Уравнение Аррениуса.
- •5.Гомогенный,гетерогенный катализ.
- •6.Колебательные реакции.
- •7.Химическое равновесие. Const химич-го равновесия.
- •8.Смещение химического равновесия. Принцип Ле-Шателье.
- •3.Растворы.
- •1.Способы выражения концентрации растворов.
- •2.Степень и const электролитической диссоциации.Закон разбавления Оствальда.
- •3.Диссоциация солей,кислот,оснований,амфотерных гидроксидов.
- •4.Произведение растворимости.
- •5.Диссоциация воды. Рн. Ионное произведение воды.
- •6.Гидролиз солей,степень и константа гидролиза.
5.Гомогенный,гетерогенный катализ.
Гомогенный катализ-катализатор и реагирующие вещества находятся в одном агрегатном состоянии и механизм действия сводится к следующему виду А+В=АВ(протекает медленно)
1.А+К=АК
2.АК+В=АВ+К
катализатор способствует понижению энергии активации,а скорость реакции повышается.
Гетерогенный катализ-катализатор и реагирующие вещества находятся в разных агрегатных состояниях,реакция протекает на поверхности раздела фаз и связано с явлением адсорбции(накопление частиц на поверхности). Механизм действия:состоит из 5 стадий
1.диффузия частиц к поверхности катализатора.
2.адсорбция частиц на поверхности катализатора.
3.химическая реакция.
4.десорбция продуктов реакции с поверхности катализатора.
5.диффузия частиц веществ от поверхности.
6.Колебательные реакции.
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ, реакции, в ходе которых концентрации промежут. соединений и скорость реакции испытывают колебания. Колебания м. б. периодическими, в этом случае значения c(t) колеблющихся концентраций (t - время) можно представить рядом Фурье:
![]()
где аn, bn - коэффициенты разложения ф-ции c(t) в рад (амплитуды отдельных гармонич. компонент), An - комплексные амплитуды, w - частота колебаний (i - мнимая единица). В общем случае амплитуды и частоты колебаний могут изменяться во времени (колебания затухающие, нарастающие, модулированные). Колебания концентраций промежут. соед. могут быть непериодическими или иметь непрерывный спектр. Колебания концентраций промежут. соед. - относительно редкое явление, наблюдаемое в ходе некоторых сложных реакций. Элементарные хим. реакции являются релаксац. процессами, обеспечивающими монотонное приближение реагирующей системы к состоянию термодинамич. равновесия. Для возникновения колебаний в ходе гомог. изотермич. реакции необходимо наличие промежут. соед. и взаимодействие между ними. В открытых системах существуют стационарные состояния, в которых концентрация c(i) i-го промежут. соед. не зависит от времени (сi=c0i).
7.Химическое равновесие. Const химич-го равновесия.
Химическое равновесие-состояние системы, при котором концентрация исходных веществ и продуктов реакции не изменяются скорости прямой и обратной реакции равны. Концентрации веществ в момент равновесия называются равновесными.
Кс-константа
равновесия-отношение произведения
равновесных концентраций продуктов
реакции к произведению равновесных
концентраций исходных веществ,взятых
в степенях равных их коэффициентам в
уравнении реакции.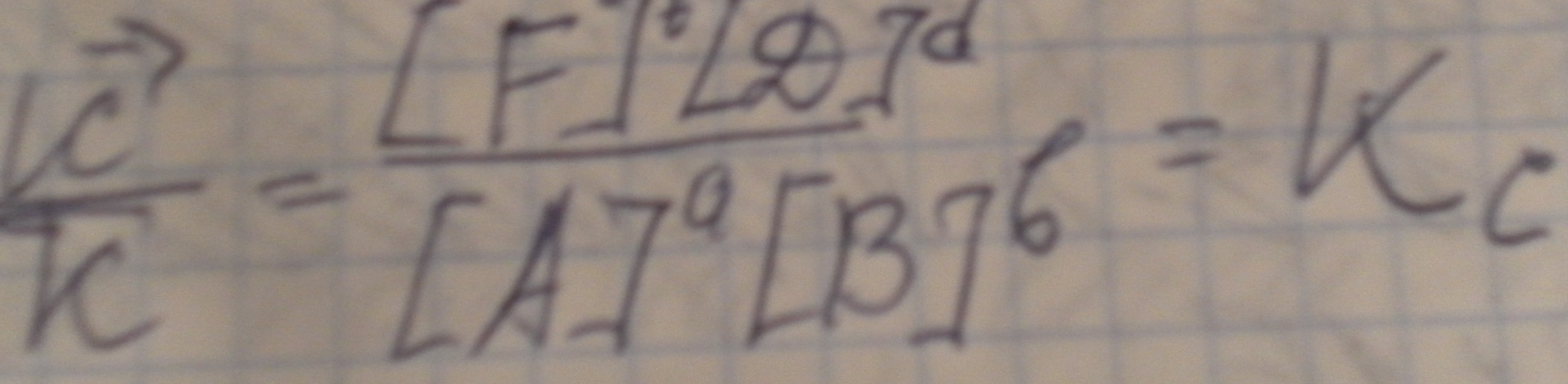
Если Кс>1 то в системе протекает прямая реакция,т.е равновесие смещено вправо.
Если Кс<1,то это обратная реакция,равновесие смещено влево.
8.Смещение химического равновесия. Принцип Ле-Шателье.
Направление смещения хим.равновесия определяется ринципом Ле-Шателье:Если на систему,находящуюся в состоянии хим.равновесия,оказывать внешнее воздействие,то равновесие смещ-ся в сторону той реакции,которая ослабляет это воздействие.
1.Влияние температуры. Согласно принципу Ле-Шателье,при повышении температуры равновесие смещается в сторону эндотермической реакции,а при понижении температуры в сторону экзотермической.
2.Влияние давления.При повышении давления равновесие смещается в сторону реакции, протекающей с уменьшением количества газообразных веществ. А при понижении давления, в сторону увеличения количества газов.
3.Влияние концентрации. При повышении концентрации одного из веществ равновесие смещается в сторону расхода этого вещества,а при понижении в сторону его образования.
