
- •42.. Ионное произведение воды. Водородный показатель (pH раствора)
- •43,Гидролиз солей. Гидролиз по катиону, гидролиз по аниону (примеры). Константа и степень гидролиза.
- •44Буферные р-ры, их классификация и состав
- •8. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •9. Химическая связь: понятие, параметры (энергия связи, длина связи, валентный угол), потенциал ионизации, сродство к электрону, электроотрицательность.
- •11. Метод валентных связей (- и -связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.
- •10.Типы химической связи: ионная, ковалентная ( типы ковалентной связи, полярность), координационная, металлическая, водородная.
- •12. Термодинамические системы: открытые, закрытые, изолированные; гомогенные и гетерогенные. Параметры системы.
- •13. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •14.Первое (закон сохранения энергии) и второе начало термодинамики.
- •15. Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
- •16.Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
- •18. Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •19. Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20.Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •21. Осмотическое давление. Законы Вант-Гоффа и Рауля.
- •23.Степень диссоциации. Сильные (активность, коэффициент активности, ионная сила) и слабые (константа диссоциации, закон разведения Оствальда) электролиты.
- •22. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу.
- •24. Малорастворимые электролиты, произведение растворимости.
- •25. Константа воды. Водородный показатель (pH).
- •26. Буферные растворы.
- •27.Гидролиз солей: типы, константа и степень гидролиза.
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •30. Электродные процессы: двойной электрический слой, (стандартный) электродный потенциал.
- •29. Методы составления уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •31. Химические источники тока: гальванические элементы (эдс), топливные элементы, аккумуляторы.
- •32. Электролиз: понятие, отличие от гальванического элемента; электролиз расплавов солей и растворов электролитов. Закон Фарадея.
- •33. Коррозия металлов: понятие, виды (химическая, электрохимическая), защита металлов от коррозии.
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •35. Гетерогенные дисперсные системы (типы систем, поверхностные явления).
- •36. Химические свойства s-элементов, их оксидов и гидроксидов.
- •37. Жесткость воды (временная, постоянная), способы ее устранения.
– электродный потенциал.
Если погрузить металлическую пластину в раствор его соли, то образуется 2-ой слой, но возможны 2 механизма образования этого слоя:
 в
в
 или
или
 в
в



Экспериментально
измерять
нельзя. На практике используется
разность потенциалов
между данным электродом и электродом
сравнения.
В качестве электрода сравнения часто
используют стандартные
электроды.
Водородный
электрод –
платиновая пластина, покрытая платиновой
чернью и погруженная в раствор
 или
или
 с активностью ионов
равной
с активностью ионов
равной
 .
.
Напряжённость (потенциал) стандартного водородного электрода:

Напряжённость (потенциал) каждого электрода зависит от:
природы металла
активности его ионов в растворе
абсолютной температуры
Уравнение Нернста:
 ,
где
,
где –
напряжённость
(потенциал) стандартного водородного
электрода,
–
напряжённость
(потенциал) стандартного водородного
электрода, – число Фарадея,
– число Фарадея, – активность
– активность
 .
.
31. Химические источники тока: гальванические элементы (эдс), топливные элементы, аккумуляторы.
Гальванический элемент Даниэля-Якоби: система, где 2 элемента находятся в растворах собственных ионов ( -пластина погружена в раствор и -пластина погружена в раствор ).

Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
На поверхности
-пластины
возникает 2-ой электронный слой и
устанавливается равновесие
 ,
также и на поверхности
-пластины
возникает 2-ой электронный слой и
устанавливается равновесие
,
также и на поверхности
-пластины
возникает 2-ой электронный слой и
устанавливается равновесие
 .
Возникают потенциалы у
и
.
.
Возникают потенциалы у
и
.
потенциалы у и .
При замыкании внешней цепи происходят процессы самопроизвольного растворения Zn и выделения Cu (потенциал Zn-электрода имеет более отрицательное значение, чем потенциал Cu-электрода, поэтому при замыкании внешней цепи, электроны будут переходить от Zn к Cu). Процессы идут до тех пор, пока не выровняются потенциалы или не растворится Zn.
Топливные элементы – элементы, в которых окислитель и восстановитель хранятся вне элемента и в процессе работы раздельно подаются к электродам, которые не расходуются.
Удельная энергия топливных элементов значительно выше удельной энергии гальванических элементов.
В топливных
элементах используются жидкие или
газообразные восстановители (
,
,
 )
и окислители (обычно
воздуха).
)
и окислители (обычно
воздуха).
В отличие от гальванических элементов, топливные элементы не могут работать без вспомогательных устройств.
Электрохимическая энергоустановка – установка, состоящая из:
- батареи топливных элементов,
- системы хранения, обработки и подвода топлива и окислителя,
- системы отвода продуктов реакции,
- системы поддержания и регулирования температуры в элементах,
- преобразователя тока и напряжения.
Аккумуляторы – устройства, в которых электрическая энергия превращается в химическую энергию, а химическая – снова в электрическую.
Процесс накопления химической энергии называют зарядом аккумулятора, а процесс превращения химической энергии в электрическую – разрядом аккумулятора. При заряде аккумулятор работает как электролизёр, при разряде – как гальванический элемент.
Процесс заряда-разряда аккумулятора осуществляется многократно.
Наиболее распространёнными являются свинцовые аккумуляторы, в которых в качестве электродов используются
 -решётки,
а в качестве электролита – раствор
и дистиллированной
(поэтому они ещё называются кислотными
аккумуляторами).
-решётки
вначале заполняются
-решётки,
а в качестве электролита – раствор
и дистиллированной
(поэтому они ещё называются кислотными
аккумуляторами).
-решётки
вначале заполняются
 ,
который при взаимодействии с
превращается в
,
который при взаимодействии с
превращается в
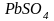 .
Электроды разделяются друг от друга
раствором
и сепараторами. Аккумуляторы соединяют
в батарею, которую помещают в баки из
эбонита или полипропилена.
.
Электроды разделяются друг от друга
раствором
и сепараторами. Аккумуляторы соединяют
в батарею, которую помещают в баки из
эбонита или полипропилена. – суммарная
реакция
– суммарная
реакция
в батарею, которую помещают в баки из эбонита или полипропилена.
(суммарная реакция)
32. Электролиз: понятие, отличие от гальванического элемента; электролиз расплавов солей и растворов электролитов. Закон Фарадея.
Электролиз – ОВР, протекающая на электродах при прохождении электрического тока через раствор или расплав электролита.
При электролизе катод (отрицательный электрод) является восстановителем, т.к. он отдает электроны катионам, а анод (положительный электрод) – окислителем, т.к. он принимает электроны от анионов. Восстановительное и окислительное действие электрического тока во много раз сильнее химических восстановителей и окислителей. Электролиз расплавленных электролитов и их растворов протекает по-разному. В последнем случае в процессах могут участвовать молекулы воды. Например, электролиз расплава NaCl:
катод (-): Na+ + e = Na0
анод (+): 2Cl- - 2e = Cl20
электролиз
2NaCl ------------ 2Na+Cl2.
В случае водных растворов на электродах могут разряжаться также ионы Н+ и OH- – продукты диссоциации воды:
катод (-) : 2H+ + 2e = H20
анод (+) : 4OH- - 4e = O2 + 2H2O.
Возможны три случая протекания восстановительного процесса на катоде:
1. В случае солей благородных металлов (стоящих правее водорода в ряду напряжений) при электролизе происходит восстановление катионов самих металлов.
2. Катионы активных металлов (от Li до Al включительно в ряду напряжений) не восстанавливаются на катоде, а вместо них восстанавливаются катионы водорода воды.
3. Катионы менее активных металлов (от Al до H2 в ряду напряжений) при электролизе на катоде восстанавливаются одновременно с катионами водорода воды.
Процессы на аноде. Анионы, не содержащие кислорода (Cl-, Br-, S-2), окисляются легче, чем ОН-. Если же анионы электролита содержат кислород, то окисляются не они, а анионы ОН-.
Основной закон электролиза (закон Фарадея): количество вещества, окисленного на аноде или восстановленного на катоде, пропорционально количеству прошедшего через раствор или расплав электричества:
газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах;
б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать:
а) в электролитах — в растворах солей, кислот, щелочей, в морской воде;
б) в атмосфере любого влажного газа;
в) в почве.
Коррозию металлов можно затормозить изменением потенциала металла, пассивацией металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов. Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам и др.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
Электрохимическая защита. Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением защищаемой конструкции металла с более отрицательным значением электродного потенциала — протектора, а также катодной (катодная защита) или анодной (анодная защита) поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью. Катодная защита используется для защиты от коррозии подземных трубопроводов, кабелей.
электричества:
 , где m – масса вещества, образовавшегося
на электроде, г; Э – эквивалентная
масса вещества, г/моль; I – сила тока,
А; t – время, с; F – число Фарадея (96500
Кл/моль).
, где m – масса вещества, образовавшегося
на электроде, г; Э – эквивалентная
масса вещества, г/моль; I – сила тока,
А; t – время, с; F – число Фарадея (96500
Кл/моль).
Э=А/n, где А – атомная масса элемента, n – его зарядность в соединении.
33. Коррозия металлов: понятие, виды (химическая, электрохимическая), защита металлов от коррозии.
Коррозия — это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают:
а) газовую коррозию - в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером
Внутренняя сфера – комплекс, включающий центральный ион или атом, вокруг которого координируются “-, +” заряженные ионы или нейтральные молекулы. Внутренняя сфера заключается в скобки. [Zn(OH)4]+²; [Zn(NH3)4]-². Центральный ион или атом называется комплексообразователем, координирующие им ионы или молекулы – лиганды.
Число лигандов, координированных комплексообразователем – координационное число. В зависимости от заряда различают анионные комплексы [Al(OH)4]-, [Zn(CN)4]²-, катионные [Cu(NH3)4]²+ и нейтральные [Pt(NH3)2Cl2]
Нейтральные не имеют внешней среды.
Заряд комплекса = алгебраическая сумма заряда центрального иона и заряда лигандов Z[Al(OH)4]-=ZAl3++ 4ZOH-=3+(-4)=-1
Комплексообразователи – атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию увеличивается с увеличением Z иона.
Лиганды – к числу лигандов относятся простые анионы F-, Cl-, B-, J-, S2- сложные анионы СN-, NCS-, NO2-, молекулы лигандов имеют неподеленные пары е.
В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (1 орбиталь) NH3; Cl-; бидентантные, например N2H4 полидентантные. (сколько σ-связей между лигандом комплексообразователем). Би-, полидентантные лиганды при взаимодействии с комплексообразователями образуют замкнутые циклы – (клешневидные) хелатные.
