
- •42.. Ионное произведение воды. Водородный показатель (pH раствора)
- •43,Гидролиз солей. Гидролиз по катиону, гидролиз по аниону (примеры). Константа и степень гидролиза.
- •44Буферные р-ры, их классификация и состав
- •8. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •9. Химическая связь: понятие, параметры (энергия связи, длина связи, валентный угол), потенциал ионизации, сродство к электрону, электроотрицательность.
- •11. Метод валентных связей (- и -связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.
- •10.Типы химической связи: ионная, ковалентная ( типы ковалентной связи, полярность), координационная, металлическая, водородная.
- •12. Термодинамические системы: открытые, закрытые, изолированные; гомогенные и гетерогенные. Параметры системы.
- •13. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •14.Первое (закон сохранения энергии) и второе начало термодинамики.
- •15. Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
- •16.Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
- •18. Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •19. Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20.Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •21. Осмотическое давление. Законы Вант-Гоффа и Рауля.
- •23.Степень диссоциации. Сильные (активность, коэффициент активности, ионная сила) и слабые (константа диссоциации, закон разведения Оствальда) электролиты.
- •22. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу.
- •24. Малорастворимые электролиты, произведение растворимости.
- •25. Константа воды. Водородный показатель (pH).
- •26. Буферные растворы.
- •27.Гидролиз солей: типы, константа и степень гидролиза.
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •30. Электродные процессы: двойной электрический слой, (стандартный) электродный потенциал.
- •29. Методы составления уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •31. Химические источники тока: гальванические элементы (эдс), топливные элементы, аккумуляторы.
- •32. Электролиз: понятие, отличие от гальванического элемента; электролиз расплавов солей и растворов электролитов. Закон Фарадея.
- •33. Коррозия металлов: понятие, виды (химическая, электрохимическая), защита металлов от коррозии.
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •35. Гетерогенные дисперсные системы (типы систем, поверхностные явления).
- •36. Химические свойства s-элементов, их оксидов и гидроксидов.
- •37. Жесткость воды (временная, постоянная), способы ее устранения.
Константа химической реакции связана с : , где А – предэкспоненциальный множитель (связан с вероятностью и числом столкновений).
Одним из наиболее распространённых в химической практике методов ускорения химических реакций является катализ. Катализаторы – вещества, изменяющие химической реакции за счёт участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав.
Существуют 2 вида катализаторов:
Гомокатализаторы (окислениеСО)
Гетерокатализаторы (окисление SO2 до SO3)
Биологические катализаторы – ферменты.
Ингибиторы – вещества, замедляющие химической реакции.
Промоторы – вещества, усиливающие действие катализаторов.
18. Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
Реакции, которые протекают только в одном направлении и идут до конца – необратимые (образование осадка, выделение газа). Их мало.
Большинство реакций
– обратимые:
 .
.
Согласно закону действия масс:


 – химическое
равновесие.
– химическое
равновесие.
Состояние системы, в которой прямой реакции = обратной реакции, называется химическим равновесием.



С увеличением
температуры,
 :
:
для эндотермической реакции возрастает
для экзотермической реакции убывает
для T = const остаётся постоянным
Влияние различных факторов на положение химического равновесия определяется принципом Ла-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
В состоянии
равновесия
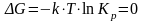 .
.
19. Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
Раствор – газообразная, твёрдая или жидкая гомогенная система состоящая из 2-х или более элементов относительное содержание которых может изменяться в неограниченных пределах. Он состоит из растворённого вещества и растворителя, в котором это вещество равномерно распределено в виде молекул и ионов.
Важной характеристикой любого раствора является его состав, который выражается концентрацией.
Массовая доля – отношение массы растворённого вещества X к общей массе раствора m :
 (обычно выражается в процентах %)
(обычно выражается в процентах %)Мольная доля – отношение количества растворённого вещества X к сумме количеств всех компонентов в растворе:
 ,
где
,
где
 – молярная масса для 2-х компонентов.
– молярная масса для 2-х компонентов.

Молярная концентрация – отношение количества растворённого вещества к объёму раствора:
 (выражается в
(выражается в
 ,
например, 2 М
,
например, 2 М
 ,
в единице раствора 2 моля
).
,
в единице раствора 2 моля
).
Эквивалентная (нормальная) концентрация – отношение количества эквивалентов растворённого вещества к объёму раствора:
 (выражается в
(выражается в
 )
)
Химическим эквивалентом называется некоторая условная или реальная частица, которая может в реакциях присоединить или высвободить 1 ион водорода:
 ,
где
,
где
 – эквивалентная масса
– эквивалентная масса



Моляльная концентрация – отношение количества растворённого вещества к массе растворителя:
 (выражается в
(выражается в
 ).
).
20.Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
Вещества, которые
диспергированы в растворе в виде молекул
– неэлектролиты.
Растворение – не чисто механический
процесс, связанный с простым дроблением
и вещества и его распределением в
растворе. При растворении происходит
уменьшение свободной энергии Гиббса
,
Растворение идёт до тех пор, пока не
наступит динамическое равновесие между
растворяемым веществом и растворителем,
т.е. пока
 .
Такой раствор называется насыщенный.
.
Такой раствор называется насыщенный.
В разбавленных растворах неэлектролитов можно пренебречь силами межмолекулярного взаимодействия между молекулами растворяемого вещества. Их можно рассматривать как результат механического смешивания компонентов, не сопровождающегося тепловым эффектом
( и
и
 ).
).
Процесс самопроизвольного переноса вещества, приводящий к установлению равновесия концентрации, называется диффузией. Движущей энергией диффузии является стремление молекул обоих компонентов к равномерному распределению по всему объёму.
Односторонняя
диффузия через полупроницаемую мембрану
называют осмосом
(например, проникновение
 в сахарозу).
в сахарозу).
21. Осмотическое давление. Законы Вант-Гоффа и Рауля.
Давление, которое
необходимо приложить к раствору, чтобы
прекратился осмос, называется осмотическим
давлением.
Растворы с одинаковым осмотическим
давлением называются изотоническими.
Осмотическое давление раствора
неэлектролита пропорционально
концентрации растворённого вещества
и абсолютной температуре. Закон
Вант-Гоффа:
 .
.
Пар, находящийся
в равновесии с жидкостью называется
насыщенным.
Каждая жидкость имеет определённое
давление насыщенного пара, которое
увеличивается с увеличением температуры.
Жидкость закипает тогда, когда давление
пара становится равным атмосферному
давлению:
 .
.
Давление пара над раствором всегда меньше давления пара над растворителем.
1-ый
Закон Рауля:
относительное понижение давления
насыщенного пара растворителя над
раствором равно мольной доле растворённого
вещества:



Поскольку температура кипения и температура замерзания зависит от давления насыщенного пара, то понижение давления пара над раствором неэлектролита повышает температуру кипения и понижает температуру замерзания.
Все эти отклонения,
а также способность элементов проводить
электрический ток, объяснила теория
электролитической диссоциации Аррениуса.
Суть её сводится к тому, что электролиты
при растворении в воде распадаются
(диссоциируют) на ионы
положительные (катионы) и отрицательные
(анионы). В
результате диссоциации увеличивается
общее число частиц в растворе. Поэтому
возникает отклонение от законов
Вант-Гоффа и Рауля. Увеличение числа
частиц учитывает изотопический
коэффициент i
:

 .
.
Согласно теории электролитической диссоциации:
Кислоты – соединения, при диссоциации которых образуются ионы водорода:

Основания – соединения, при диссоциации которых образуются ионы гидроксила:

Соли – соединения, при диссоциации которых образуются катионы металлов и анионы кислотного остатка:

23.Степень диссоциации. Сильные (активность, коэффициент активности, ионная сила) и слабые (константа диссоциации, закон разведения Оствальда) электролиты.
Отношение числа
распавшихся молекул на ионы к общему
числу молекул в растворе называется
степенью
диссоциации:
 .
.
По склонности к диссоциации электролиты делятся на:
сильные
( )
и
слабые
(
)
и
слабые
( ).
).
К сильным электролитам относятся:
Практически все соли
Ряд неорганических кислот (HF, HCL, HBr, HJ, ,
 )
)Гидроксиды металлов 1-ой и 2-ой группы
В сильных электролитах степень диссоциации , поэтому имеет место высокая концентрация заряжённых частиц. Естественно они взаимодействуют друг с другом. Это связывание ионов понижает концентрацию ионов. Такое явление называется активностью: a = fC, где
f–коэффициент активности, C–концентрация
Для очень разбавленных растворов коэффициент активности f = 1 (взаимодействия нет), т.е. a = C.
раствором неэлектролита повышает температуру кипения и понижает температуру замерзания.
2-ой закон Рауля: повышение температуры кипения и понижение температуры замерзания раствора неэлектролита пропорциональны моляльной концентрации растворённого вещества.
 ,
где Э – эбулиоскопическая
постоянная
,
где Э – эбулиоскопическая
постоянная
 ,
где K
– криоскопическая
постоянная
,
где K
– криоскопическая
постоянная
Э и К зависят от природы растворителя.
22. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу.
В отличие от растворов неэлектролитов, растворы электролитов не подчиняются законам Вант-Гоффа и Рауля. Эти растворы имеют большее осмотическое давление, большее повышение температуры кипения, большее понижение температуры замерзания. Мерой отклонения растворов неэлектролитов от закономерности неэлектролитов служит изотопический коэффициент:

Активность a зависит от заряда иона и ионной силы.
Ионная сила раствора – это полусумма произведений концентраций всех находящихся в растворе ионов на квадрат их заряда:
 .
.
К слабым электролитам относятся:
Органические кислоты (
 ,
,
 );
);Ряд неорганических кислот (
 ,
,
 ,
,
 и др.);
и др.);Слабые основания (
 );
);Гидроксиды металлов (кроме 1-ой и 2-ой группы);
В растворах слабых электролитов одновременно присутствуют молекулы и ионы растворённого вещества, при этом между ними устанавливается динамическое равновесие:

В соответствии с законом действующих масс, константа равновесия:
 или
или

Константа равновесия
слабых электролитов называется
константой
диссоциации
 .
.
Закон разведения
Оствальда:
 (
(


 )
)
Закон Оствальда позволяет рассчитать степень диссоциации слабых электролитов при различных концентрациях, если известен коэффициент диссоциации (справочный).
24. Малорастворимые электролиты, произведение растворимости.
К малорастворимым электролитам относятся:
Подавляющее число веществ ограниченно растворимы в воде
Применение закона
действующих масс к гетерогенной системе,
в которой находятся и осадок и раствор
в равновесии:
 даёт выражение константы
равновесия:
даёт выражение константы
равновесия:
 (произведение
растворимости).
(произведение
растворимости).
