
- •25. Частота столкновений молекул идеального газа. Средняя длина свободного пробега газовых молекул.
- •26. Явления переноса: диффузия, внутреннее трение, теплопроводность.
- •27. Испарение и кипение жидкостей. Насыщенный пар. Влажность воздуха. Точка росы.
- •28. Учет объема газовых молекул сил межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса.
- •29. Теоретические и опытные изотермы реального газа. Критические параметры.
25. Частота столкновений молекул идеального газа. Средняя длина свободного пробега газовых молекул.
Молекулы, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l,
который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но т. к. мы имеем дело с огромным числом хаотически движущихся молекул, то можно говорить о средней длине свободного пробега молекул <l>.
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. (рис.1). Он зависит от скорости сталкивающихся молекул, т.е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости <v>, и если <z> — среднее число столкновений, испытываемых одной молекулой газа за 1 с, то
средняя длина свободного пробега <l>=<v>/<z>.
![]()
Рис.1 рис.2
Для определения <z> представим молекулу в виде шарика радиусом d, которая движется среди других «застывших» молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри «ломаного» цилиндра диаметром d(рис. 2).
Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра:<z>=nV, где n-концентрация молекул, V =d2 <v>, <v>— средняя скорость молекулы или путь, пройденный ею за 1 с. Таким образом, среднее число столкновений <z>=nd2 <v>.
Предположение
о том, что все молекулы, кроме одной,
неподвижны, является не верным. В
действительности все молекулы движутся,
и возможность соударения двух частиц
зависит от их относительной скорости.
Поэтому вместо среднеарифметической
скорости <v>
должны входить средняя относительная
скорость молекул <vотн>.
Если скорости молекул распределены
по закону Максвелла, то, как можно
показать, средняя относительная скорость
двух молекул однородного газа в раз
превышает
 .
Таким образом, среднее число соударений
должно быть увеличено в
раз, <z>=n=
.
Таким образом, среднее число соударений
должно быть увеличено в
раз, <z>=n=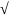 2d2
<v>.
2d2
<v>.
Тогда
средняя длина свободного пробега <l>=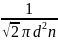 , т.е. <l>
обратно
пропорциональна концентрации п
молекул.
С
другой
стороны, из уравнения p=nkT
следует, что при постоянной температуре
п
пропорциональна
давлению р.
Следовательно,
, т.е. <l>
обратно
пропорциональна концентрации п
молекул.
С
другой
стороны, из уравнения p=nkT
следует, что при постоянной температуре
п
пропорциональна
давлению р.
Следовательно,
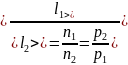 .
.
Таким образом, средняя длина свободного пробега не зависит от температуры газа, т.к. с ростом температуры одновременно возрастают и <v>, и <z>. При подсчете числа соударений и средней длины свободного пробега молекул за модель молекулы было принято шарообразное упругое тело. В действительности каждая молекула представляет собой сложную систему элементарных частиц и при рассмотрении упругого соударения молекул имелось в виду, что центры молекул могут сблизиться до некоторого наименьшего расстояния. Затем возникает силы отталкивания которые вызывают взаимодействие, подобное взаимодействию при упругом ударе.
