
- •1. Параметры состояния рабочего тела (названия, определения, обозначения, единицы измерения). Уравнение состояния идеального газа.
- •4. Теплоемкость (определение, понятия Су, Ср, мСх, Сх. Использование теплоемкости при определении теплоты).
- •5. 1 Закон термодинамики (физическая суть, математическая запись, понятия внутренней энергии и энтальпии).
- •6. Первый закон тд для потока
- •9. Цикл Карно.
- •10.Эквивалентный цикл Карно.
- •14) Адиабатный процесс:
- •15.Политропный процес:
- •17. Реальные рабочие
- •18.Диаграммы и таблицы воды и водяного пара
- •19.Процесс получения перегретого пара
- •24.Движение жидкости и газов в каналах(уравнение сплошности и 1 закона термодинамики для потока, выражения для определения скорости и расхода, условия ускорения потока)
- •25.Истечение газов и паров через сужающиеся каналы
- •26. Сопло Лаваля.
- •28. Термодинамический анализ работы карбюраторных двс (принцип действия, изображение процессов в pv и ts координатах, анализ эффективности)
- •29. Термодинамический анализ работы дизельных двс (принцип действия, изображение процессов в pv и ts координатах, анализ эффективности)
- •30. Гту(схема, изображение цикла в pv и Ts координатах, анализ эффективности)
- •31.Выработка электроэенргии на тепловых электростанциях
- •32.Тепловые электростанции с вторичным перегревом пара
- •33. Тепловые электростанции с регенерацией теплоты
- •34. Термический анализ работы тэц с противодавлением
- •35. Термический анализ работы тэц с отборами пара
- •36.Холодильные парокомпрессионные машины
- •37.Влажный воздух
9. Цикл Карно.
Цикл Карно – это обратимый цикл, состоящий из 2-ух изотерм и двух адиабат .
ηt=
1- ![]() =
1- T2/T1
= ηtk.
1 теор. Карно
–эффективность
цикла
=
1- T2/T1
= ηtk.
1 теор. Карно
–эффективность
цикла
Карно не зависит от свойств рабочего тела, а определяется только уровнем
Температуры горячего и холодного источников. Так как цикл Карно
обратимый, темп. Т1 = Тг , а Т2 = Тх
2 теор. Карно в заданном диапазоне температур холодного и горячего источника
мах. КПД имеет цикл Карно, работающий в этом диапазоне.
Рассмотрим цикл Карно 1234, работающий в диапазоне горячего и холодного
источника ηt
(ABCD)<ηt
(abcd)
= 1- ![]() ,
ηt
(1234)= 1-(Tx/Tr),
Tx≤T2m,
Tr≥T1m
,
ηt
(1234)= 1-(Tx/Tr),
Tx≤T2m,
Tr≥T1m
ηt (1234)≥ ηt(ABCD) . Выше рассмотрены прямые циклы, все это справедливо и для обратного. Но для обратного цикла Карно холодильный коэф.εк =

Для отопительного
коэф. φк = ![]() .
Цикл Карно идеальный в лбом случае.
.
Цикл Карно идеальный в лбом случае.
10.Эквивалентный цикл Карно.
Любой произвольный цикл АВСД, в котором подвод и отвод теплоты происходит при переменных температурах , можно заменить эквивалентным циклом Карно 1234, где q1, q2 и изменение удельной энтропии s2 – s1 соответствуют таковым в цикле АВСД .С учетом того, что
q1 = qABC = (ABC)∫ Tds = T 1 cp(s2-s1), q2= qCDA = (CDA)∫Tds = T2 cp (s2-s1). Термический КПД произвольного цикла запишем так:
ηt
ABCD
= 1- q2/q1
= 1- ![]() ,
где Т2ср и Т1ср – средние ТД температуры,
соответствующая процессам подвода и
отвода теплоты: Т1ср =
,
где Т2ср и Т1ср – средние ТД температуры,
соответствующая процессам подвода и
отвода теплоты: Т1ср = ![]() ;
T2cp
=
;
T2cp
= ![]() и
определяются как высоты прямоугольников
, одинаковых по площадям с фигурами
s1ABCs2
и s2CDAs1.
Для повышения термического КПД любого
цикла тепловых двигателей необходимо
увеличивать среднюю темп. в процессе
подвода теплоты(Т1ср) и уменьшать среднюю
темп. в процессе отвода теплоты (Т2ср).
Пределом терм. КПД произвольного цикла,
осуществляемого между крайними
температурами Т мах и Т міn является
терм. КПД цикла Карно при Т1ср = Тмах и
Т2ср = Тміn, следовательно в данном
интервале температур цикл Карно обладает
наибольшей эффективностью .
и
определяются как высоты прямоугольников
, одинаковых по площадям с фигурами
s1ABCs2
и s2CDAs1.
Для повышения термического КПД любого
цикла тепловых двигателей необходимо
увеличивать среднюю темп. в процессе
подвода теплоты(Т1ср) и уменьшать среднюю
темп. в процессе отвода теплоты (Т2ср).
Пределом терм. КПД произвольного цикла,
осуществляемого между крайними
температурами Т мах и Т міn является
терм. КПД цикла Карно при Т1ср = Тмах и
Т2ср = Тміn, следовательно в данном
интервале температур цикл Карно обладает
наибольшей эффективностью .
11) Изобарный процесс : ( р=const )
В р-V
координатах графикпроцессаизображаетсягоризонтальнойпрямой
1-2:
р-V
координатах графикпроцессаизображаетсягоризонтальнойпрямой
1-2:
Рис. График ізобарного процесса с идиальным газом в pV-координатах.
Записав уровнения состояния для двух точек процесса зависимость между изеняющиемися параметрами идеального газа в изобарном процессе: V2/V1=T2/T1.
Измененияудельнойвнутренийєнергииидеального газа определяется выражениям
![]() ).
Удельнаяработа
, выполняемая
в изобарном процессе:
).
Удельнаяработа
, выполняемая
в изобарном процессе: ![]()
Так
как для идеального газа pV2=RT2и
pV1=RT1
,
то ![]() .
.
Если
в изобарном процессе температура 1кг
идеального газа изменится на 1К, то
![]() ,
т.е удельная газовая постоянная – эта
работа, совершаемая 1кг идеального газа
в изобарном процессе при изменении его
температуры на 1К. Удельное количество
теплоты можно определить:
,
т.е удельная газовая постоянная – эта
работа, совершаемая 1кг идеального газа
в изобарном процессе при изменении его
температуры на 1К. Удельное количество
теплоты можно определить:![]() , т.е. удельное количество теплоты в
изобарном процессе равно изменению
удельной энтальпии идеального газа.
Для идеального газа:
, т.е. удельное количество теплоты в
изобарном процессе равно изменению
удельной энтальпии идеального газа.
Для идеального газа: ![]()
Выражения
для расчета изменения удельной энтропии
идеального газа в изобарном процессе
можно получить: ![]() или
или ![]() .
.
Следовательно, на TS-диаграмме изобара является также логарифмической кривой.
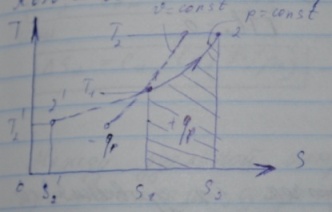
Так какСр>СV, то следует что изобара более пологая, чем изохора.
Доля
удельной теплоты, расходуемой на
изменения удельной внутренней энергии
идеального газа в изобарном процессе,![]() 1/k,
т.е. изобарный процес этотакойпроцесс,
в котором 1/К
1/k,
т.е. изобарный процес этотакойпроцесс,
в котором 1/К
Доля удельнойтеплотырасходуется на изменениеудельнойвнутреннейэнергииидеального газа.
12)Изохорный процесс ( V=const). ВpV-координатах график процесса представляет собой прямую линию, паралельную оси Op. Процесс может протекать как с повышением лавления( прямая 1-2 , так и с его понижением ( прямая 1-2’).

Записав для крайних точек 1,2 уравнения состояния и разделив их почленно, получим зависимости
между параметрами идеального газа в изохорном процессе:
p1V=RT1,p2V=RT2илиp2/p1=T2/T1.
В
изохорном процессе dV=o
и термодинамическая работа не совершается
(![]() =o).
Потому вся теплота расходуется только
на изменение внутренней энергии
идеального газа.
=o).
Потому вся теплота расходуется только
на изменение внутренней энергии
идеального газа.
QV=![]()
Выражения
для расчета изменения удельной энтропии
идеального газа в изохорном процессе
можно получить на основании
![]() S=S2-S1=Cvmln(T2/T1)
+ Rln(
V2/V1)
, положив V1=V2:
SV=CVmln(T2/T1)
S=S2-S1=Cvmln(T2/T1)
+ Rln(
V2/V1)
, положив V1=V2:
SV=CVmln(T2/T1)
или SV=CVmln(p2/p1).
Между удельной энтропией и температурой идеального газа существует логарифмическая зависимость. BTs-координатах эта зависимость изображается кривой 1-2:
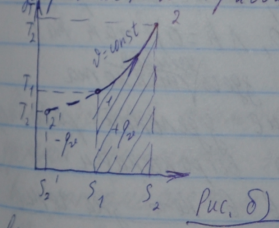
Схема энергетического баланса для изохорного процесса показана на рис. а). Доля удельной теплоты,
расходуемой
на изменение удельной энергии идеального
газа: ![]() , поскольку qV=
UV.
, поскольку qV=
UV.
13) Изотермический процесс ( T=const ):
Уравнение процесса вытикает из уравнения состояния идеального газа: pV=RT=const.
НаpV-диаграммеизотерма изображается равнобокой гиперболой:

Между давлением и обьемом существует обратно пропорциональная зависимость.
Удельны
внутренняя энергия и энтальпия
идеального газа в изотермическом
процессе не изменяются (
U=0,
![]() =0),
так как dT=0.
Вся подведенная здесь удельная теплота
расходуется определяется выражениям:
=0),
так как dT=0.
Вся подведенная здесь удельная теплота
расходуется определяется выражениям:
![]()
Удельная теплота, необходимая для осуществления процесса:
q1=lT=RTln(V2/V1)=RTln(p1/p2)
или
qT=T(S22-S1)
Выражения для расчета изменения удельной энтропии идеального газа в изотерм., процесса:
ST=S2-S1=q1/T=Rln(V2/V1)=Rln(p1/p2)
График изотермического процесса в Ts-координатах:
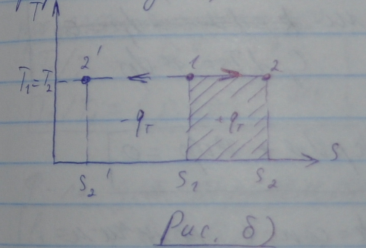
Доля
удельной теплоты, расходуемой на
изменение удельной внутренней энергии
идеального газа в изотермическом
процессе: ![]() .
.
