
- •Оптика часть а 2010 год Интерференция и дифракция света
- •Тепловое излучение. Фотоэффект. Давление света
- •Импульс, масса, энергия фотона. Длина волны де-Бройля
- •Атом водорода в теории Бора и квантовой механике. Спектральные серии. Плотность вероятности. Квантовые числа
- •Теплоемкость. Энергия Ферми. Зоны. Полупроводники
- •Энергия связи. Ядерные реакции. Радиоактивный распад
Атом водорода в теории Бора и квантовой механике. Спектральные серии. Плотность вероятности. Квантовые числа
1. Если
радиус первой орбиты электрона в атоме
водорода
![]() м,
то, согласно постулату Бора, угловая
скорость вращения электрона на этой
орбите равна …рад/с. (
м,
то, согласно постулату Бора, угловая
скорость вращения электрона на этой
орбите равна …рад/с. (![]() .
.
1.
![]() 2.
2.
![]() 3.
3.
![]() 4.
4.
![]()
2. Если скорость электрона на первой орбите атома водорода равна 2·106 м/с, то согласно постулату Бора, радиус этой орбиты равен …. пм.
1. 116 2. 5 3. 29 4. 58
3. Кинетическая Ек, потенциальная Еп и полная Е энергия атома связаны между собой соотношением …
1. Е = Еп = ½ Ек 2. Е = – Еп = ½ Ек
3. Е = – Ек = ½ Еп 4. Е = 2Ек = 2Еп
4. Кинетическая Ек и потенциальная Еп энергии электрона в атоме водорода при переходе от нижних уровней к верхним изменяются следующим образом …
1. Ек – убывает, Еп – возрастает
2. Ек – возрастает, Еп – убывает
3. Ек – убывает, Еп – убывает
4. Ек – возрастает, Еп – возрастает
5. При переходе электрона атома водорода с четвертой орбиты на первую его потенциальная энергия …
1. увеличивается в 4 раза
2. уменьшается в 16 раз
3. увеличивается в 16 раз
4. изменяется только полная энергия
6. При переходе электрона атома водорода с 5-й на 1-ую стационарную орбиту, его энергия …
1. уменьшается в 25 раз
2. увеличивается в 25 раз
3. увеличивается в 5 раз
4. уменьшается в 5 раз
7. На рисунке представлена схема энергетических уровней атома водорода. Если энергия атома водорода 13,6 эВ, то излучению наименьшей длины волны на схеме соответствует фотон с энергией … эВ.

1. 1,89 2. 3,41 3. 13,62 4. 12,1
8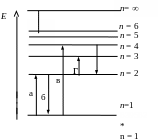 . Поглощению
наибольшей длины волны ультрафиолетовой
серии, показанной на рис., соответствует
переход …
. Поглощению
наибольшей длины волны ультрафиолетовой
серии, показанной на рис., соответствует
переход …
1. а
2. б
3. в
4. г
9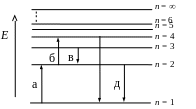 . На
схеме энергетических уровней атома
водорода (рис.) излучению наибольшей
длины волны в ультрафиолетовой серии
Лаймана соответствует переход …
. На
схеме энергетических уровней атома
водорода (рис.) излучению наибольшей
длины волны в ультрафиолетовой серии
Лаймана соответствует переход …
1. а
2. б
3. в
4. д
1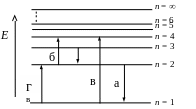 0. На
схеме энергетических уровней атома
водорода поглощению наименьшей длины
волны в ультрафиолетовой серии Лаймана
соответствует переход …
0. На
схеме энергетических уровней атома
водорода поглощению наименьшей длины
волны в ультрафиолетовой серии Лаймана
соответствует переход …
1. а
2. б
3. в
4. г
1 1. Излучению
наибольшей длины волны в видимой серии
соответствует переход, рис. …
1. Излучению
наибольшей длины волны в видимой серии
соответствует переход, рис. …
1. а
2. б
3. в
4. г
1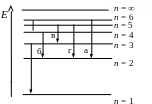 2. Излучению
наименьшей длины волны в видимой серии
соответствует переход, рис. …
2. Излучению
наименьшей длины волны в видимой серии
соответствует переход, рис. …
1. а
2. б
3. в
4. г
13. При
переходе иона Li![]() из возбужденного состояния в основное
излучаемому фотону с минимальной
энергией соответствует длина волны …
нм.
из возбужденного состояния в основное
излучаемому фотону с минимальной
энергией соответствует длина волны …
нм.
1. 740 2. 400 3. 13,5 4. 121,5
14. Фотон с энергией 13,6 эВ выбивает электрон из атома водорода. Кинетическая энергия вылетевшего электрона равна … эВ.
1. 13,6 2. 3,4 3. 10,2 4. 0
15. Коротковолновая граница серии Бальмера определяется соотношением …
1.
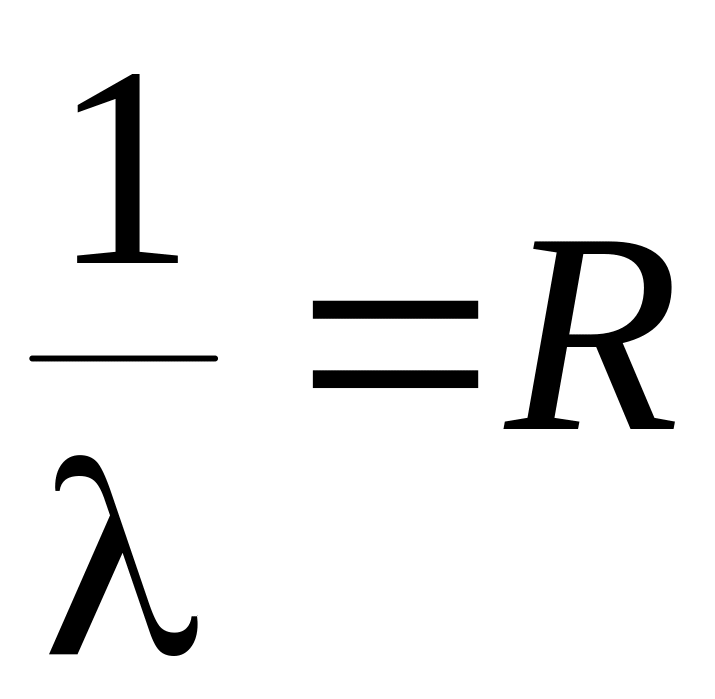 2.
2.
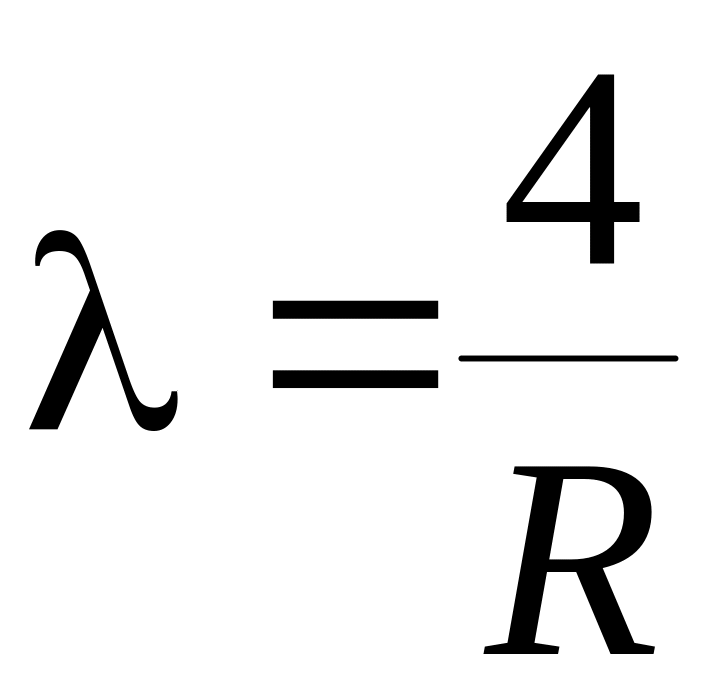 3.
3.
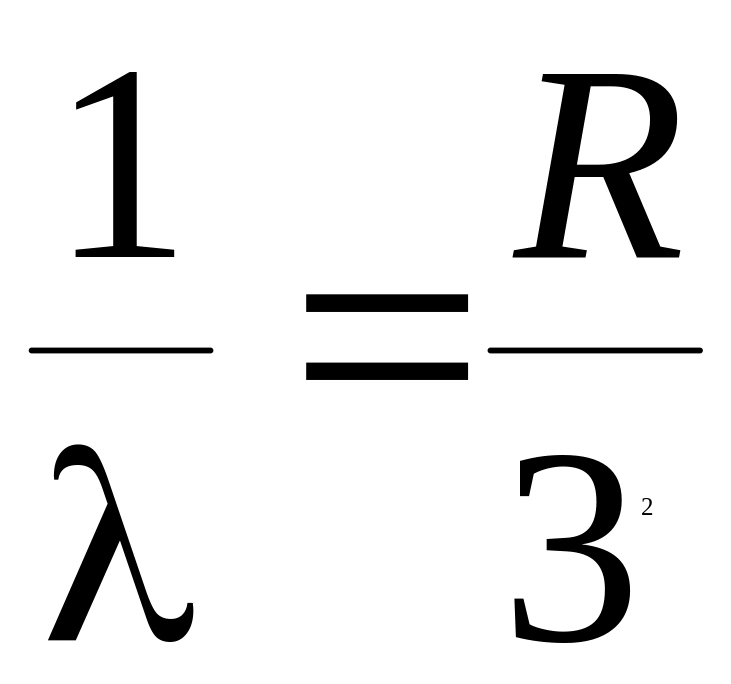 4.
4. 
16. Коротковолновая граница серии Лаймана определяется соотношением
1. 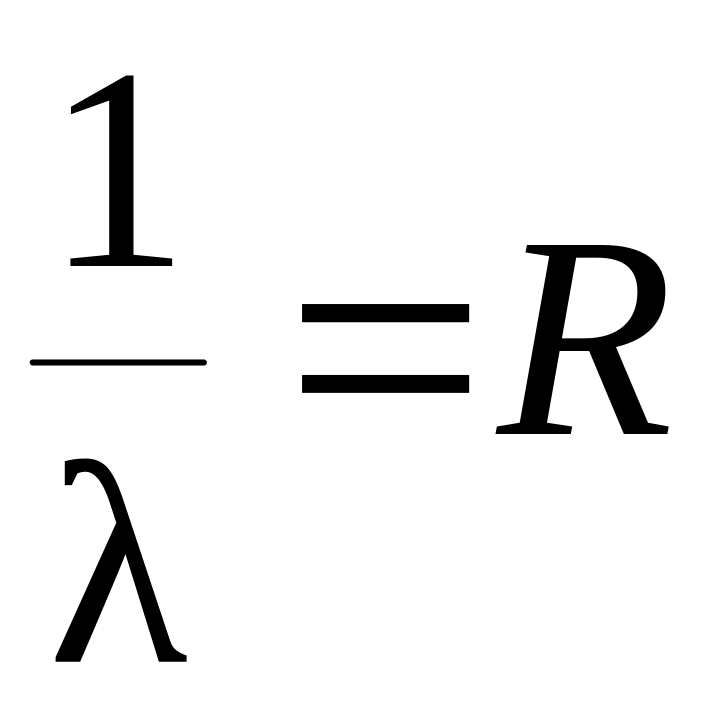 2.
2. 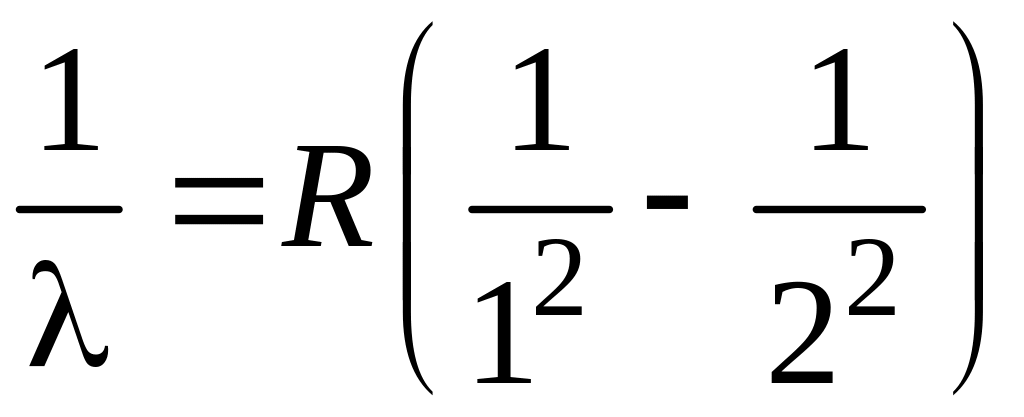 3.
3. 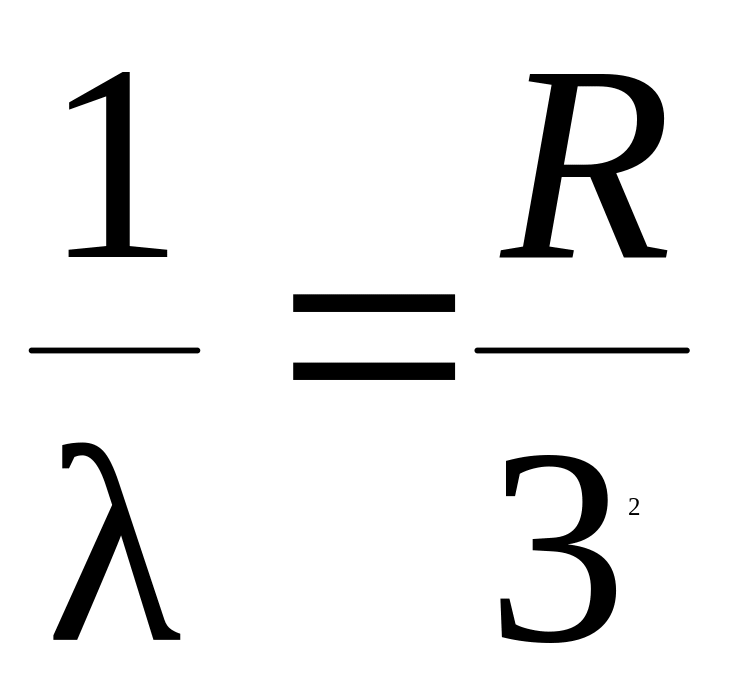 4.
4.
17. Фотон,
соответствующий коротковолновой границе
серии Лаймана иона Не![]() ,
выбивает электрон из атома водорода.
Кинетическая энергия вылетевшего
электрона … эВ.
,
выбивает электрон из атома водорода.
Кинетическая энергия вылетевшего
электрона … эВ.
1. 40,8 2. 27,2 3. 0 4. 24,2
18. Фотон, соответствующий первой линии серии Лаймана иона Не+, выбивает электрон из покоящегося атома водорода. Кинетическая энергия вылетевшего электрона равна … эВ.
1. 16,8 2. 24,2 3. 36 4. 27,2
19. Отношение максимальной частоты фотона в серии Бальмера к минимальной частоте в серии Пашена в спектре атома водорода равно …
1. 2,86 2. 2,25 3. 5,3 4. 5,1
20. Длина волны де-Бройля электронов, при соударении с которыми в видимой серии спектра атома водорода проявились две линии, равна … (R = 1,097·107 м-1 – постоянная Ридберга).
1.
![]() 2.
2.
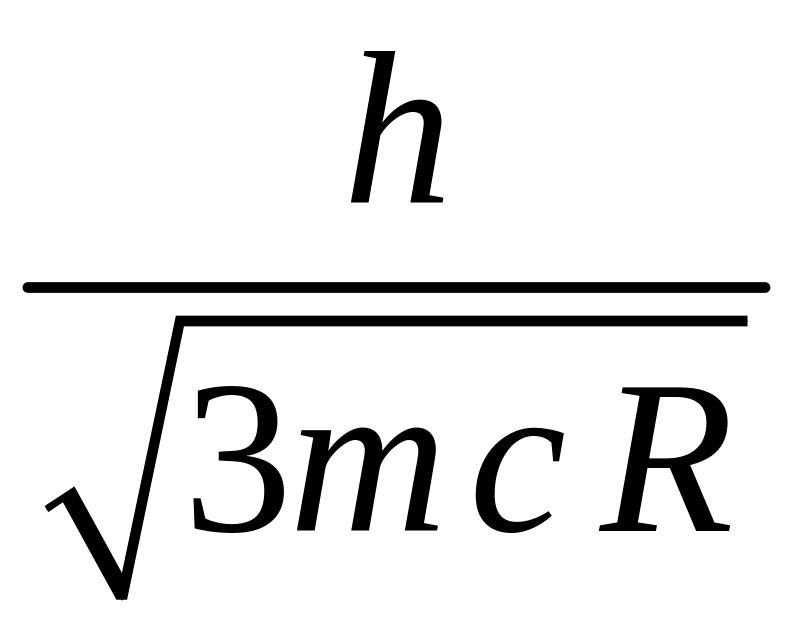 3.
3.
![]() 4.
4.
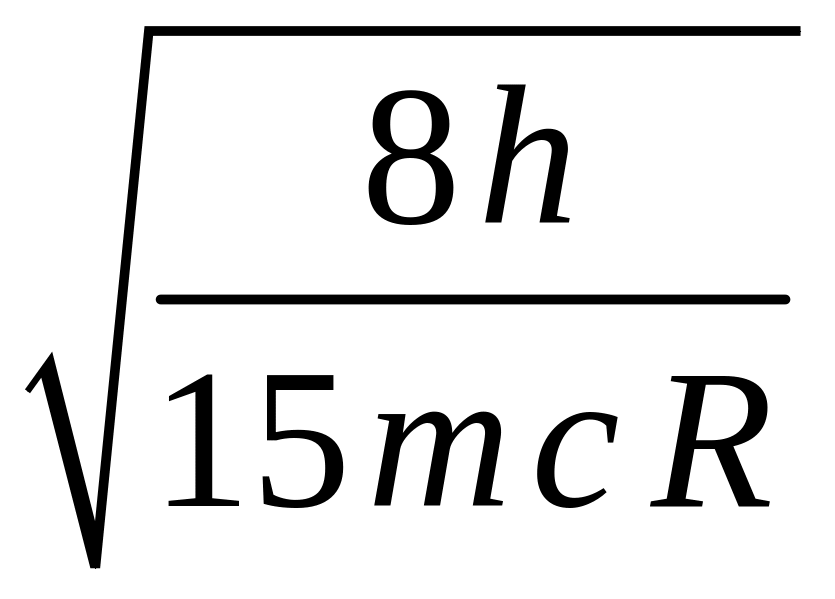
21. Длина
волны де-Бройля электронов, при соударении
с которыми в спектре атома водорода
проявились все линии всех серий, равна
(![]() м
м![]() )
…
)
…
1.
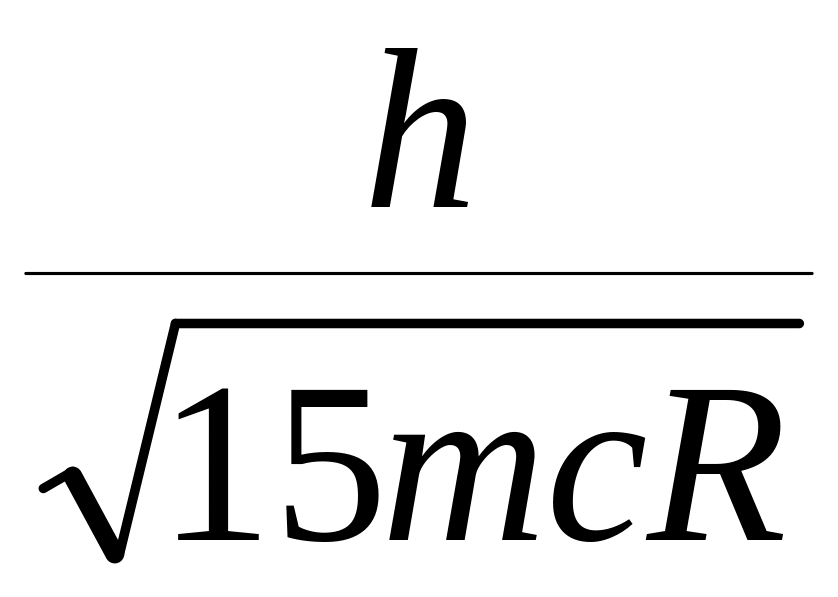 2.
2.
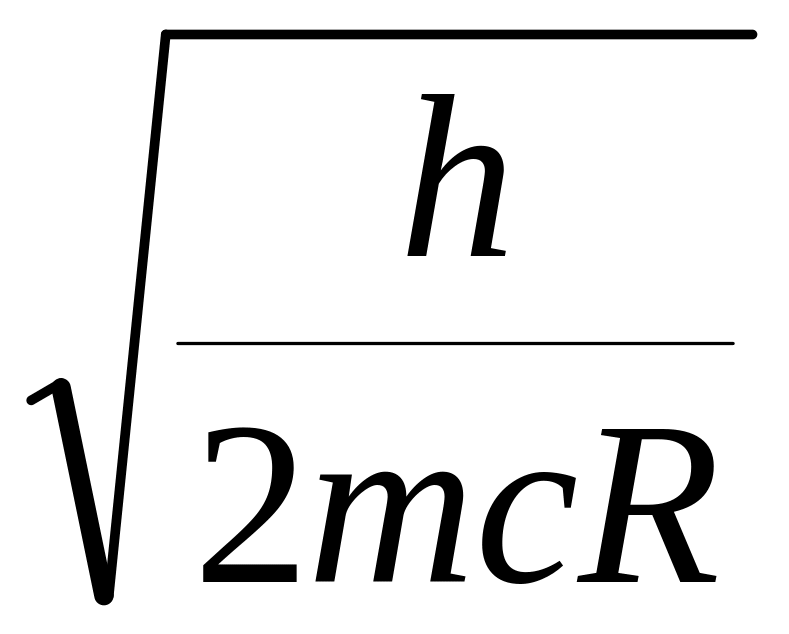 3.
3.
 4.
4.

22. Атомарный
водород при переходе из возбужденного
состояния в основное испустил только
три спектральные линии. Максимальной
частотой из них обладает линия с длиной
волны …нм. (![]() .
.
1. 98 2. 450 3. 325 4. 293
23. На длине орбиты частицы, обладающей волновыми свойствами, укладывается …
1. четное число волн де-Бройля 2. нечетное число волн де-Бройля
3. целое число волн де-Бройля 4. бесконечное число волн де-Бройля
24. Если скорость электрона на первой орбите атома водорода равна 2·106 м/с, то согласно постулату Бора, радиус этой орбиты равен … пм.
1. 116 2. 5 3. 29 4. 58
25. Энергия фотона, испускаемого при переходе электрона в атоме водорода с 3-го на 2-й энергетический уровень, равна … эВ.
1. 13,6 2. 12,4 3. 10,2 4. 1,89
26. При переходе электрона атома водорода с 3-й на 1-ю стационарную орбиту его энергия …
1. увеличивается в 9 раз 2. уменьшается в 9 раз
3. увеличивается в 3 раз 4. уменьшается в 3 раз
27. Фотон с энергией 15 эВ выбивает электрон из покоящегося атома водорода, находящегося в основном состоянии. Скорость электрона вдали от ядра равна … м/с.
1. 7·105 2. 7·106 3. 9·107 4. 0,49·105
28. Если энергия ионизации атома водорода Еi = 13,6 эВ, то 1-й потенциал возбуждения этого атома … В.
1. 13,6 2. 10,2 3. 13,6 4. 3,4
29. Импульс фотона, вызвавшего ионизацию атома водорода, равен … .
1.
![]() 2.
2.
![]() 3.
3.
![]() 4.
4.
![]()
30. Фотон с энергией 13,6 эВ выбивает электрон из атома водорода. Кинетическая энергия вылетевшего электрона равна … эВ.
1. 0 2. 3,4 3. 10,2 4. 13,6
31. Потенциал ионизации атома водорода = 13,6 В. Импульс фотона, вызвавшего ионизацию атома водорода, равен … .
1.
2.
![]() 3.
4.
3.
4.
32. Импульс
фотона, вызвавшего
ионизацию
атома водорода, равен
…
.
![]() .
.
1.
2.
![]() 3.
4.
3.
4.
33. Частица
в прямоугольной потенциальной яме,
шириной l
находится во втором возбужденном
состоянии. Плотность вероятности
нахождения частицы максимальна в точке
интервала (0< x <![]() )
…
)
…
1. х
=
![]() 2. х
=
3. х
=
2. х
=
3. х
=
![]() 4. х
=
4. х
=
![]()
34. На
рисунке изображена плотность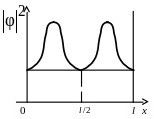 вероятности обнаружения микрочастицы
на различных расстояниях от ,,стенок”
ямы. Вероятность её обнаружения на
участке l
/4< х <
l …
вероятности обнаружения микрочастицы
на различных расстояниях от ,,стенок”
ямы. Вероятность её обнаружения на
участке l
/4< х <
l …
1.![]() 2.
3.
4. 0
2.
3.
4. 0
35. Если d – ширина барьера, U0 – высота барьера, Е – энергия микрочастицы, то вероятность туннельного эффекта для одной и той же микрочастицы наибольшая в случае …
1. U0–E= 1 эВ, d = 10-10 м
2. U0–E= 2 эВ, d = 2·10-10 м
3. U0–E= 2 эВ, d = 4·10-10 м
4. U0–E= 10 эВ, d = 10-10 м
36. Установить соответствие квантовых чисел, определяющих волновую функцию электрона в атоме водорода их физическому смыслу …
квантовое число физический смысл
1. n А. Определяет ориентацию электронного
облака в пространстве
2. l Б. Определяет форму электронного облака
3. m В. Определяет размеры электронного облака
Г. Собственный механический момент
1. 1-Г, 2-Б, 3-А 2. 1-А, 2-Б, 3-В
3. 1-В, 2-Б, 3-А 4. 1-В, 2-А, 3-Г
37. Магнитное квантовое число m определяет …
1. энергию атома
2. момент импульса орбитального движения электрона
3. проекцию орбитального момента импульса электронов на направление магнитного поля
4. один электрон
38. Магнитное квантовое число m определяет …
1. ориентацию электронного облака в пространстве
2. размеры электронного облака
3. форму электронного облака
4. проекцию спинового момента на внешнее поле
39. Электрон в атоме находится в s-состоянии. Наименьший угол, который может образовать вектор орбитального момента импульса электрона с направлением магнитного поля, равен …
1. arccos(2/3) 2. 90º 3. arcsin(2/3) 4. 0º
40. Электрон в атоме находится в f-состоянии. Орбитальный момент импульса L электрона равен …
1. 3![]() 2.
2. ![]() 3.
3. ![]() 4.
4. ![]()
41. Отношение орбитальных моментов импульса электронов, находящихся в s и d-состояниях равно …
1.
2.
![]() 3. 0 4.
3. 0 4.
![]()
42. Электрон в атоме водорода находится в р-состоянии. Возможные проекции орбитального момента импульса электрона на направление магнитного поля равны … .
1. 0![]() 2
2. 0
1
2
3. 0
1
4. 0
1
2
2. 0
1
2
3. 0
1
4. 0
1
43. Электрон в атоме водорода находится в 3р-состоянии. При переходе атома в основное состояние изменение орбитального момента импульса электрона равно ….
1.
![]() 2.
2.
![]() 3.
3.
![]() 4.
4.
![]()
44. Заполненный электронный слой характеризуется квантовым числом n = 3. В этом слое число электронов, имеющих одинаковое квантовое число ml = – 1, равно …
1. 2 2. 8 3. 4 4. 6
45. Для электрона в состоянии 2 S возможен следующий набор квантовых чисел n, l, ml, ms …
1. 2, 0, 0, 1/2 2. 2, 0, 1, – 1/2 3. 1, 0, 0, 1/2 4. 2, 1, 0, – 1/2
46. В состоянии 2S могут находиться 2 электрона со следующими квантовыми числами n, l, ml, ms …
1. 2, 0, 0, 1/2; 1, 0, 0, – 1/2 2. 1, 0, 0, + 1/2; 2, 0, 0, – 1/2
3. 2, 1, 0, + ½ ; 2, 0, 0, – 1/2 4. 2, 0, 0, + 1/2; 2, 0, 0, – 1/2
47. Момент импульса орбитального движения электрона, находящегося в S-состоянии, равен … Дж с.
1. 1, 5 10![]() 2. 1,06
10
3.
4. 0
2. 1,06
10
3.
4. 0
48. Электрон в атоме находится в p-состоянии. Наибольший угол, который может образовать вектор орбитального момента импульса электрона с направлением магнитного поля, равен …
1. arccos(2/3) 2. 90º 3. arcsin(2/3) 4. 0º
49. Электрон в атоме водорода находится в d-состоянии. Возможные проекции орбитального момента импульса электрона на направление магнитного поля равны …
1. 0, ħ,
2ħ
2. 0, ħ,
2ħ,
3ħ
3. 0,
![]() ħ
4. 0,
ħ,
2ħ
ħ
4. 0,
ħ,
2ħ
50. Электрон в атоме водорода находится на третьем энергетическом уровне. Возможные значения орбитального момента импульса электрона равны …
А. 0
Б.
В. ![]() Г.
Г. ![]()
1. А, Б 2. В, Г 3. А, В 4. А, Б, Г
51. Отношение орбитальных моментов импульса электронов, находящихся в состоянии p и d, равно …
1.
2.
3. ![]() 4.
4. ![]()
52. Орбитальный момент импульса электрона, находящегося в 4d состоянии, равен … ħ.
1. ![]() 2.
2. ![]() 3.
3. ![]() 4.
4.
53. Отношение орбитальных моментов импульса электронов, находящихся в состоянии f и P, равно …
1.
2.
3. ![]() 4.
4. ![]()
54. Отношение орбитальных моментов импульса электронов, находящихся в состояниях f и d равно …
1. 0
2.
![]() 3.
3.
![]() 4.
4.
55. Электрон в атоме водорода находится в p-состоянии. Возможные проекции орбитального момента импульса электрона на направление магнитного поля равны …
1. 0, ħ, 2ħ 2. 0, ħ 3. 0, ħ, 2ħ 4. 0, ħ, 2ħ, 3ħ
56. Электрон в атоме водорода находится в d-состоянии. Возможные проекции орбитального момента импульса электрона на направление магнитного поля равны … .
1. 0 2 2. 0 1 2 3. 0 1 4. 0 1±2 ±3
57. Заполненной электронной оболочке соответствует главное квантовое число n = 3. Определить число электронов в этой оболочке, которые имеют одинаковые следующие квантовые числа: ms = – 1/2.
1. 9 2. 6 3. 12 4. 11
58. Электрон
в атоме водорода находится в 3![]() -состоянии.
При переходе атома в 2р-состояние,
изменение орбитального момента импульса
электрона равно … ħ.
-состоянии.
При переходе атома в 2р-состояние,
изменение орбитального момента импульса
электрона равно … ħ.
1. 0 2. 1,4 3. 1,04 4. 0,73
59. Вектор собственного магнитного момента электрона имеет в магнитном поле число ориентаций, равное
1. ml 2. 2 l+1 3. 2 4. n2 5. n
60. Максимальное число электронов, находящихся в L-слое равно:
1. 8 2. 6 3. 2 4. 18 5. 32
