
- •8) Теплоотдача при обтекании плоской поверхности (пластины)
- •10) Теплоотдача при движении жидкости в трубе.
- •12) Теплообмен при турбулентном режиме течения
- •19) Понятие о термодинамических циклах. Термический коэффициент полезного действия цикла
- •20) Излучение газов
- •24) Термодинамический анализ процессов в компрессорах
- •30) Цикл двс со смешанном подводе тепла
19) Понятие о термодинамических циклах. Термический коэффициент полезного действия цикла
Работа за процесс - площадь под графиком на PV - диаграмме, но если мы используем только один термодинамический процесс, мы вернемся в конечную точку по тому же пути, и суммарная энергия перехода1 -> 2 -> 1 будет равна 0, т.е. работа равна 0.
![]()
![]()
Термодинамическим циклом называется такая совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние.
Прямой цикл - цикл, в котором система совершает положительную работу (A > 0). Примером прямого цикла является цикл, совершаемый рабочим телом в тепловом двигателе. В таком двигателе рабочее тело получает энергию в форме теплоты от внешних источников и часть ее отдает в форме работы.
Обратный цикл - цикл, в котором система совершает отрицательную работу (A < 0). Пример - цикл рабочего тела в холодильной установке. В такой установке рабочее тело получает энергию в форме работы и передает энергию в форме теплоты от холодного тела к более нагретому телу.
Термическим КПД h называется отношение работы A, совершенной рабочим телом в прямом круговом процессе, к сумме Qподв всех количеств теплоты, сообщенных в цикле рабочему телу нагревателями: h=A/Qподв.
На PV-диаграмме A - площадь внутри цикла, Qподв - площадь под верхним графиком.
Для цикла Карно: h=(T1-T2)/T1=1-T2/T1.
Чем больше КПД, тем лучше экономичность, но повышается максимальная температура в цикле, т.е. повышается степень пожарной опасности.
20) Излучение газов
Одноатомные и двухатомные газы считаются прозрачными, поскольку они обладают малой излучательной, а следовательно, и малой поглощательной способностью. Трехатомные (СО2, Н2О, SО2 и др.) и многоатомные газы обладают значительными излучательной и поглощательной способностями, и их излучение играет большую роль как в топочных устройствах, где они образуются при сгорании топлива, так и в первых газоходах котельного агрегата, в которых они движутся при относительно высоких температурах. Спектры излучения трехатомных газов имеют резко выраженный селективный, т.е. избирательный, характер, так как они в отличие от серых тел поглощают и излучают энергию только в определенных интервалах длин волн, расположенных в различных частях спектра. Расчет теплообмена излучением между газом и стенками канала, по которому движется газ, очень сложен: его выполняют с помощью графиков и таблиц.
Коэффициент теплоотдачи излучением можно определить по формуле:
![]() (9.21)
(9.21)
где бл – коэффициент теплоотдачи излучением, Вт/(м2·К);
с'ε
– эффективная степень черноты
поглощательных поверхностей, учитывающая
излучение газов:
![]() (9.22)
(9.22)
где сε – степень черноты поглоща-
тельных поверхностей; εг – суммарная
степень черноты газов:
![]() (9.23)
(9.23)
где, εСО2 и εН2О – степени черноты углекислого газа и водяных паров; в – поправочный коэффициент, которым учитывается парциальное давление водяных паров; ε г'– суммарная степень черноты газа, определяемая по формуле (9.23) при температуре поглощательной поверхности; Тс – средняя температура поглощательной поверхности, К; Тг – средняя температура газов, К, определяемая по
формуле
![]()
![]() (9.24)
(9.24)
где Tc' и Tc"– начальная и конечная температуры поглощательной поверхности стенки, К; T'г и T"г – начальная и конечная температуры газов, К.
2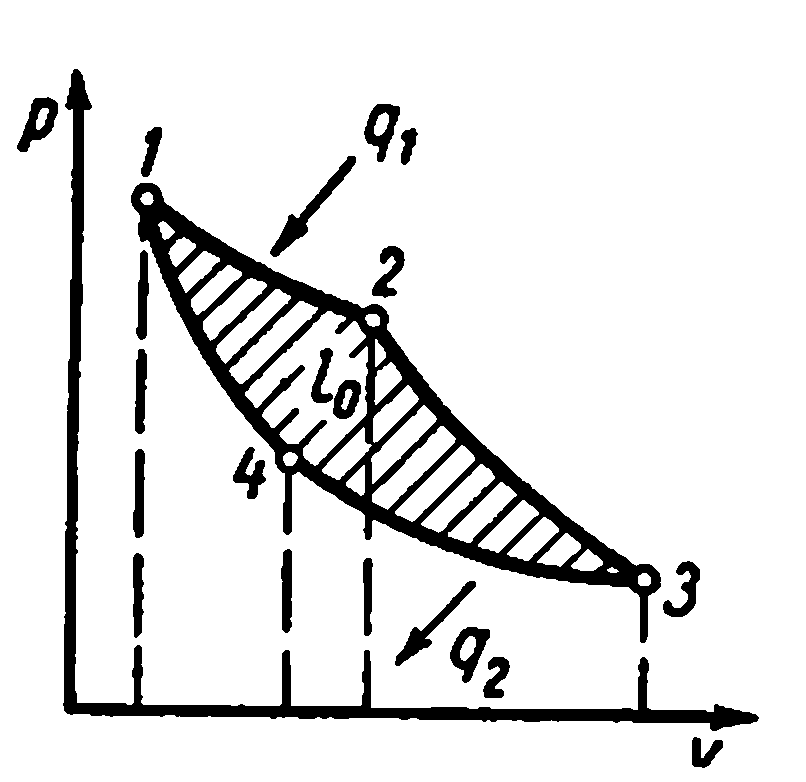 1)
Цикл Карно
- обратимый
круговой процесс, в котором совершается
превращение теплоты в работу (или работы
в теплоту).
Состоит из двух изотерм и двух адиабат.
Этот цикл представляет собой замкнутый
процесс, совершаемый рабочим телом
в идеальной тепловой машине при
наличии двух источников теплоты:
нагревателя и холодильника.
1)
Цикл Карно
- обратимый
круговой процесс, в котором совершается
превращение теплоты в работу (или работы
в теплоту).
Состоит из двух изотерм и двух адиабат.
Этот цикл представляет собой замкнутый
процесс, совершаемый рабочим телом
в идеальной тепловой машине при
наличии двух источников теплоты:
нагревателя и холодильника.
Процессы
1—2 и 3—4 являются изотермическими,
а 2—3 и 4—1 — адиабатными. Начальная
температура рабочего тела в цикле
принимается равной температуре
нагревателя T1.
При изотермическом расширении от
состояния 1 до состояния 2 рабочее
тело получает от нагревателя количество
теплоты q1 при
температуре T1.
На участке 2—3 рабочее тело адиабатно
расширяется. При этом температура
рабочего тела понижается отT1 до T2,
а давление падает от p2 до p3.
При сжатии по изотерме 3—4 от рабочего
тела отводится к холодильнику количество
теплоты q2 при
температуре T2.
Дальнейшее сжатие по адиабате 4—1
приводит к повышению температуры
рабочего тела от T2 до T1,
а рабочее тело возвращается в первоначальное
состояние. Суммарная работа
цикла lц графически
изображается площадью 12341:
![]()
Термический
к. п. д. цикла:![]()
Количество подведённой теплоты:
![]()
Количество отведённой теплоты:
![]()
Работа
цикла Карно:
![]()
Термический к.п.д. цикла:
![]()
22) Энтропия обладает всеми свойствами координаты термодинамического состояния. Так, в равновесных процессах при наличии теплового взаимодействия энтропия обязательно изменяется и остается постоянной только при отсутствии теплообмена (в адиабатном равновесном процессе dS = 0). Количество термического воздействия, т. е. количество теплоты dQ в элементарном равновесном термодинамическом процессе, пропорционально изменению энтропии, а множителем пропорциональности служит потенциал термического взаимодействия— термодинамическая температура Т.
Таким образом, количество термического воздействия, т. е. количество теплоты, может быть представлено в форме, аналогичной выражению, в виде произведения: dQ = TdS или для удельного количества теплоты: dq = Tds.
Энтропия S системы выражается в Дж/К, а удельная энтропия s однородного рабочего тела — в Дж/ (кг • К)
С микрофизической точки зрения энтропия является количественной мерой хаотичности, беспорядочности теплового движения. Увеличение энтропии соответствует уменьшению упорядоченности в расположении микрочастиц и в распределении энергии между ними. Количественная связь между микрофизическими характеристиками вещества и энтропией как макроскопической величиной устанавливается методами статистической термодинамики.
23) Закон Дальтона. В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по
свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, воздух в сушильных установках и т.д.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
(1.8)
Парциальное давление pi – давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем
смеси.
Способы задания смеси.
Состав газовой смеси может быть задан массовыми, объемными или мольными доля-
ми.
Массовой
долей
называется отношение массы отдельного
компонента mi
к м![]() ассе
смеси m:
ассе
смеси m:
gi = mi/ m. (1.9)
Очевидно, что
Массовые доли часто задаются в
процентах. Например, для сухого воздуха
gN2 ≈ 77%, go2 ≈ 23%.
