
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
5.1. Теплота процесу: поняття теплоємності тіла.
Термодинамічний процес супроводжується в загальному випадку як проведенням роботи системою (тілом), що здійснює процес, так і підведенням теплоти до неї від навколишнього середовища. Величина роботи процесу була визначена раніше; тут буде розглянута теплота процесу.
Надання тілу теплоти приводить до зміни його температури, що залежить від зовнішніх умов, у яких відбувається зміна стану тіла, тобто від характеру процесу.
Відношення
кількості теплоти
![]() отриманого
тілом при нескінченно малій рівноважній
зміні його стану, до зміні температури
тіла
отриманого
тілом при нескінченно малій рівноважній
зміні його стану, до зміні температури
тіла
![]() ,
що внаслідок цього відбулася, називається
теплоємністю тіла в даному процесі:
,
що внаслідок цього відбулася, називається
теплоємністю тіла в даному процесі:
![]()
(1.16)
Теплоємність виміряється звичайно в кілоджоулях на градус або кілокалоріях на градус.
Оскільки
відповідно до рівняння (1.16)
![]() то
загальна кількість теплоти Q,
отриманої тілом у даному рівноважному
процесі зміни стану тіла, визначається
вираженням
то
загальна кількість теплоти Q,
отриманої тілом у даному рівноважному
процесі зміни стану тіла, визначається
вираженням
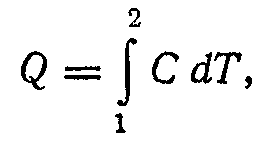
де інтеграл береться по шляху процесу від початкового стану 1 до заданого кінцевого стану 2. Із цього випливає, що кількість теплоти є функція процесу, а не стану тіла.
У термодинаміці особливе значення мають теплоємність при постійному об'ємі
![]()
яка дорівнює відношенню кількості наданої тілу теплоти dQ до обумовленої нею зміні температури dT тіла при ізохоричному процесі (V = const), і теплоємність при постійному тиску
![]()
яка дорівнює відношенню кількості теплоти dQ до зміни температури dT тіла при ізобаричному процесі (р = const).
5.2. Масова, об'ємна й мольна теплоємності
У термодинаміці розрізняють теплоємності: масову, об'ємну й мольну.
Теплоємність, віднесену до 1 кг газу, називають масовою й позначають сх. Вимірюють цю теплоємність у кДж/(кг• град).
Теплоємність, віднесену до 1 м3 газу при нормальних фізичних умовах, тобто при тиску 101325 Н/мг і температурі 0°С, називають об'ємною й позначають буквою с'х ; вимірюють її в кДж/(м3 • град).
Теплоємність, віднесену до 1 кмоль газу, називають мольною й позначають
μ сх; вимірюють її в кДж/( кмоль•град).
Між зазначеними теплоємностями існує наступний зв'язок
![]()
де v0 — питомий об'єм при нормальних термодинамічних умовах; μ — молекулярна маса.
5.3. Закон збереження і перетворення енергії
Закон збереження й перетворення енергії говорить, що енергія ізольованої системі, яка складається з усіх наявних у ній видів енергії, при будь-яких процесах, що відбуваються у системі, не змінюється. Із цього закону слідує, що зменшення якого-небудь виду енергії в одній системі, яка складається з одного або багатьох тіл, повинне супроводжуватися збільшенням енергії в іншій системі тел.
Перетворення механічного руху в теплоту відомо людині з найдавніших часів, але спроби зворотного перетворення теплоти в механічну роботу, започатковані ще до нашої ери, практично не вплинули на створення теплових двигунів аж до XVIII століття.
Лише наприкінці XVIII сторіччя були створені перші зразки парових машин (Папин, И. И. Повзунів і ін.).
Таким чином, процес перетворення теплоти в роботу був здійснений, але без усяких теоретичних розрахунків і обґрунтувань. Загальне формулювання закону збереження й перетворення енергії дав М. В. Ломоносов.
Однак, лише через сто років після нього, наука підійшла до усвідомлення і відкриття закону збереження й перетворення енергії та еквівалентності теплоти й роботи.
В 1842 р. Роберт Майер на підставі дослідів установив пряму пропорційність між витраченою теплотою Q і отриманою роботою L і визначив кількісне співвідношення між ними:
Q = AL,
де А — постійна величина, називана тепловим еквівалентом роботи.
Тепловий еквівалент одиниці роботи - величина розмірна й залежить від системи одиниць, обраних для виміру теплоти й роботи. Якщо теплота й. робота виміряються в одних одиницях (Джоулях), те еквівалент дорівнює одиниці й тоді
Q = L.
У встановленому співвідношенні Майера говориться не тільки про еквівалентність теплоти й роботи, тобто про кількісну сталість енергії, але й про зміну якості самої енергії.
У середині ХІХ століття була доведена еквівалентність електричної роботи й теплоти. Цей закон увійшов у фізику за назвою закону Джоуля - Ленца.
