
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
9.6. Політропні процеси
Дотепер розглядалися процеси, в яких були цілком визначені ознаки: ізохорний процес здійснювався при постійному об'ємі; ізобарний - при постійному тиску; ізотермічний - при постійній температурі; адіабатний - при відсутності теплообміну між робочим тілом і зовнішнім середовищем. Поряд із цими процесами можна представити ще нескінченну множину процесів, у яких є інші постійні ознаки.
Умовилися всякий процес ідеального газу, у якому теплоємність є постійною величиною, називати політропним процесом, а лінію процесу — політропою.
З визначення політропного процесу слідує, що основні термодинамічні процеси - ізохорний, ізобарний, ізотермічний і адіабатний, якщо вони протікають при постійній теплоємності, є окремими випадками політропного процесу.
Теплоємність політропного процесу сп може приймати найрізноманітніші позитивні й негативні значення від + ∞ до - ∞.
Кількість теплоти, що бере участь у політропному процесі, може бути виражено добутком теплоємності процесу сп на різницю температур Т2 — Т1 у кінцевому й початковому станах:
![]() (
7-19)
(
7-19)
Рівняння політропного процесу виводиться на підставі рівняння першого закону термодинаміки:
![]()
Із цих рівнянь знайдемо
![]()
Позначивши вираження лівої частини рівняння через п, отримаємо
![]()
Інтегруючи отримане співвідношення в межах від початку до кінця процесу, знаходимо ,
![]()
або
pvn = const. ( 7-20)
Отримане рівняння є рівнянням політропного процесу.
Показник політропи п приймає для кожного процесу певне числове значення. Для основних процесів: ізохорних п = ± ∞, ізобарних п = 0, ізотермічних п = 1 і адіабатних п = k.
Оскільки рівняння політропи відрізняється від рівняння адіабати тільки величиною показника п, то, очевидно, всі співвідношення між основними параметрами можуть бути представлені формулами, аналогічними адіабатному процесу:
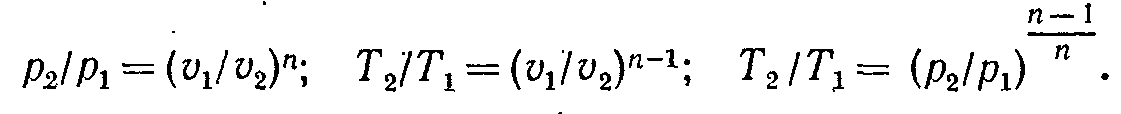
Теплоємність політропного процесу визначаємо із формули
![]() (
7-21)
(
7-21)
Рівняння ( 7-21) дозволяє визначити теплоємність політропного процесу для кожного значення п.
Якщо в рівняння ( 7-21) підставити значення п для окремих випадків, то отримуємо теплоємності розглянутих процесів:
ізохорного процесу n = ± ∞, сn = сv;
ізобарного процесу п = 0, cn = kсv = cр;
ізотермічного процесу п = 1, сn = ± ∞;
адіабатного процесу п = k, сn = 0.
Рівняння роботи зміни об'єму, чиненої тілом при політропному процесі, має аналогічний вигляд з рівнянням роботи в адіабатному процесі, тобто
![]() (
7-22)
(
7-22)
або
![]()
![]() (
7-23)
(
7-23)
Зміна внутрішньої енергії газу й теплота в політропному процесі визначаються по формулах:
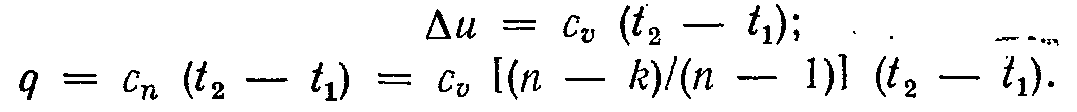 ( 7-24)
( 7-24)
Розташовувана
зовнішня
робота в політропному процесі за
аналогією з адіабатним процесом дорівнює
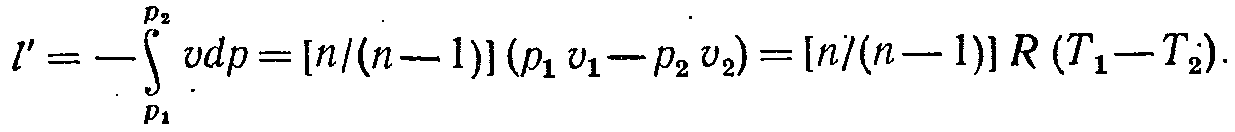 ( 7-25)
( 7-25)
Зміна ентальпії в політропному процесі
![]() (
7-26)
(
7-26)
Значення n у будь-якому політропному процесі може бути визначене по координатах двох будь-яких точок графіка:
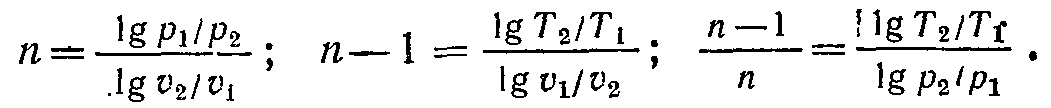 ( 7-27)
( 7-27)
Логарифмуючи рівняння політропи, отримаємо
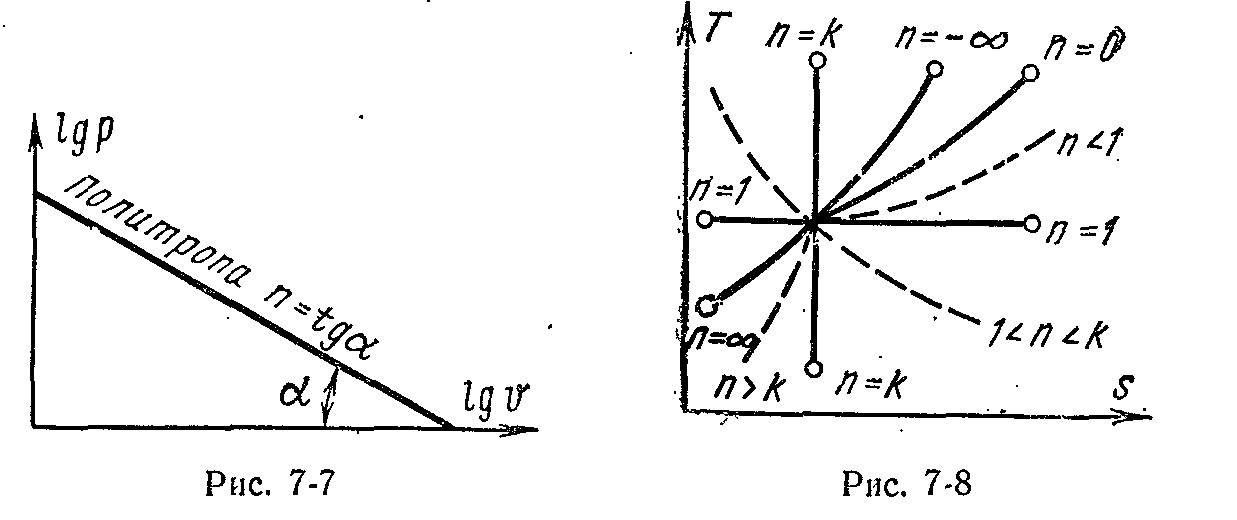
lg р + n lg v = const.
Це рівняння являє собою рівняння прямої лінії в координатах lg р і lg v, а показник політропи n — тангенс кута нахилу прямій до осі абсцис (мал. 7-7).
Зміна ентропії газу в політропному процесі визначається по формулі
ds = dq/T = cn d/T,
або для кінцевої зміни стану
![]() ( 7-28)
( 7-28)
