
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
Согласно теории электролитической диссоциации сильные электролиты полностью диссоциируют на ионы и процесс диссоциации протекает необратимо, например, H2SO4 —> 2Н+ + S042-. Вследствие высокой концентрации заряженных частиц в растворе в значительной степени проявляются силы межионного взаимодействия, количественной характеристикой которых является коэффициент активности (f). Поэтому фактическая (активная) концентрация ионов уменьшается. Аналитически молярная концентрация катионов и анионов (С±) связана с активной концентрацией (а±) соотношением
а±= С±· f±
Приближенно коэфицент активности можно вычислить по формуле

Где Z—заряд ионов;
I—ионная сила раствора электролита,вычисляемая по формуле

Где
 — концентрация ионов,моль/л;
— концентрация ионов,моль/л;
 — заряд
ионов.
— заряд
ионов.
В концентрированных растворах сильных электролитов f<<1, а в разбавленных f —>1, для них выражение а±= С±· f± можно записать в виде

В дальнейшем вместо понятия активность будет использоваться концентрация.Концентрацию ионов в сильном электролите можно рассчитать ,пользуясь соотношением:
 ·
·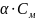
Где n — число ионов данного вида,на которые распадается одна молекула.
20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
В растворах слабых электролитов процесс диссоциации протекает обратимо. Уравнение реакции диссоциации можно в общем виде представить как
|
Константа равновесия для процесса диссоциации слабого электролита называется константой диссоциации (КД). На основании закона действия масс выражение для константы равновесия (КС) или в данном случае константы диссоциации (КД) имеет вид
|
где , – равновесные концентрации ионов в растворе электролита, моль/л; – концентрация недиссоциированных молекул, моль/л.
Константа диссоциации (КД) зависит от природы диссоциирующего вещества, растворителя, температуры и не зависит от концентрации раствора. Она характеризует способность электролита распадаться на ионы. Чем больше численное значение КД, тем в большей степени диссоциирует электролит.
Для многоосновных кислот и многокислотных оснований характерна ступенчатая диссоциация с отрывом одного иона H+ или OH– на каждой ступени, при этом значение КД при переходе от первой к последующим ступеням уменьшается:
, |
; |
, |
; |
, |
; |
, |
. |
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, многокислотные основания – основные соли.
Взаимосвязь между КД и устанавливается законом разбавления Оствальда:
|
|
где СМ – молярная концентрация раствора электролита, моль/л.
Для слабых электролитов ( << 1) это выражение упрощается:
или . |
Закон разбавления Оствальда выражает зависимость степени диссоциации слабого электролита от концентрации раствора: при уменьшении концентрации (разбавлении раствора) степень диссоциации увеличивается.
Концентрация ионов (катионов и анионов) в растворе слабого электролита определяется по формуле
|
|
Равновесие в растворах электролитов, как и всякое химическое равновесие, сохраняется неизменным при определенных условиях. Основным фактором, позволяющим смещать положение равновесия в растворах слабых электролитов, является изменение концентрации ионов. В соответствии с принципом Ле Шателье введение в раствор слабого электролита одноименных ионов (т.е. ионов, одинаковых с одним из ионов электролита) смещает равновесие в сторону недиссоциированных молекул, степень диссоциации при этом уменьшается.

 .
.
 .
.