
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
9. Первый закон термодинамики; внутренняя энергия, энтальпия.
Связь между теплотой Q и работой A и внутренней энергией U устанавливает 1й закон термодинамики. 1й закон термодинамики. Энтальпия. Кол-во энергии , которое выделяется или поглощается системой в форме теплоты и работы равно изменению ее внутренней энергии.
Кол-во
теплоты, подведенное к системе, расходуется
на изменение ее U и
совершения системой работы.
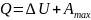 ;
;
 ;
;
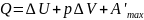 ;
1) V=const.
Пусть
;
1) V=const.
Пусть
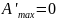 ,
тогда
,
тогда
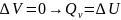 (экзотермическая
(экзотермическая
 ,
эндотермическая
,
эндотермическая
 (1);
2) p=const.
Пусть
(1);
2) p=const.
Пусть
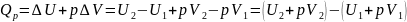 ;
;

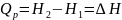 ;
;
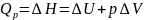 (2).
H – энтальпия
– полный запас энергии расширенной
системы при p=const.
Уравнения (1) и (2) показывают, что
энергетические эффекты при V=const
и p=const
отличаются на величину
(2).
H – энтальпия
– полный запас энергии расширенной
системы при p=const.
Уравнения (1) и (2) показывают, что
энергетические эффекты при V=const
и p=const
отличаются на величину
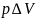 ,
тогда
,
тогда
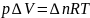
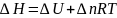 –изменение моль газа в ходе реакции.
Для
конденсированных систем (нет газов)
–изменение моль газа в ходе реакции.
Для
конденсированных систем (нет газов)
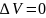 ,
тогда
,
тогда
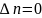 ;
;

10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
Кол-во теплоты, подведенное к системе, расходуется на изменение ее U и совершения системой работы. ; ; ; 1) V=const. Пусть , тогда (экзотермическая , эндотермическая (1); 2) p=const. Пусть ;
; (2). H – энтальпия – полный запас энергии расширенной системы при p=const. Энтальпия (теплосодержание) зависит от природы и массы вещества, его агрегатного состояния (не зависит от пути и способа проведения процесса). Это величина экстенсивная, выражется в Дж/моль. Уравнения (1) и (2) показывают, что энергетические эффекты при V=const и p=const отличаются на величину , тогда –изменение моль газа в ходе реакции. Для конденсированных систем (нет газов) , тогда ;
Теплоты,
выделяемая или поглощаемая при протекании
физико-химических процессов при условии,
что процесс протекает непрерывно при
постоянном объеме или давлении и
единственным видом работы является
работа против внешнего давления,
называется тепловым эффектом. Соотношения
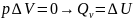 и
и
 позволяют определять тепловые эффекты:
при постоянном объеме он равен внутренней
энергии
,
при постоянном давлении – изменению
энтальпии
.
Процессы, протекающие с выделением
теплоты называются экзотермическими
,
а с поглощением теплоты – эндотермическими
.
Тепловой эффект процесса можно рассчитать,
если известны теплоты образования
исходных веществ и продуктов, образующихся
в результате протекания реакции.
Изобарной теплотой образования сложного
вещества
позволяют определять тепловые эффекты:
при постоянном объеме он равен внутренней
энергии
,
при постоянном давлении – изменению
энтальпии
.
Процессы, протекающие с выделением
теплоты называются экзотермическими
,
а с поглощением теплоты – эндотермическими
.
Тепловой эффект процесса можно рассчитать,
если известны теплоты образования
исходных веществ и продуктов, образующихся
в результате протекания реакции.
Изобарной теплотой образования сложного
вещества
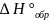 называется количество энергии, выделяемое,
реже поглощаемое, при образовании 1 моль
сложного вещества из простых. Если
исходные вещества и продукты реакции
находятся в стандартных условиях (T=298K
и p=101,3 кПа), то теплота
образования 1 моля соединения называется
стандартной теплотой образования
.
Для большинства сложных веществ
стандартные теплоты образования
приведены в справочных таблицах; для
простых веществ (H2, O2,
N2 и др.) – условно приняты
равными нулю.
называется количество энергии, выделяемое,
реже поглощаемое, при образовании 1 моль
сложного вещества из простых. Если
исходные вещества и продукты реакции
находятся в стандартных условиях (T=298K
и p=101,3 кПа), то теплота
образования 1 моля соединения называется
стандартной теплотой образования
.
Для большинства сложных веществ
стандартные теплоты образования
приведены в справочных таблицах; для
простых веществ (H2, O2,
N2 и др.) – условно приняты
равными нулю.
Стандартным состоянием вещества называется такая его фаза, агрегатное состояние которой или модификация, которая является устойчивой при стандартных условиях T=298®K p=101кПа
