
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
Химическое равновесие – состояние обратимого процесса, при котором скорости прямой и обратной реакции равны. Концентрации реагирующих веществ, установившиеся к моменту наступления равновесия, называют равновесными, они остаются постоянными до нарушения химического равновесия.
 –
кинетическое
условие равновесия.
–
кинетическое
условие равновесия.
Состояние химического равновесия существует при строго определенных условиях: концентрации, температуре, давлении. При изменении одного из этих условий равновесие нарушается вследствие неодинакового изменения скоростей прямой и обратной реакций. Переход из одного равновесного состояния в другое называется сдвигом или смещением положения равновесия. Если скорость прямой реакции становится больше скорости обратной реакции, равновесие смещается вправо. Если скорость прямой реакции становится меньше, чем скорость обратной, то равновесие смещается влево. С течением времени в системе устанавливается новое химическое равновесие, которое характеризуется равенством скоростей и новыми равновесными концентрациями всех веществ в системе.
Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в направлении той реакции, которая ослабляет это воздействие.
Применительно к трем основным типам внешнего воздействия – изменению концентрации, давления и температуры – принцип Ле Шателье трактуется следующим образом.
1. При увеличении концентрации одного из реагирующих веществ равновесие смещается в направлении той реакции, по которой это вещество расходуется; при уменьшении концентрации одного из реагирующих веществ равновесие смещается в сторону образования этого вещества.
2. При изменении температуры изменяются как прямая, так и обратная реакции, но в разной степени. Для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции. При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической.
3. При увеличении давления равновесие смещается в сторону уменьшения числа молей газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания числа молей газов, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молей газообразных веществ, то давление не влияет на положение равновесия в этой системе.
6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
Константа
равновесия является количественной
характеристикой состояния равновесия.
Вывод
константы равновесия для р-ии

Запишем
кинетическое условие равновесия
используя ЗДМ(закон действия масс)
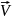 =
= ;
;

Представим
данное равенство в виде пропорции

Аналогично
можно получить величину
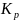
 Величины
и
Величины
и
 не зависят от C
и P.
Зависят от природы реагирующих
веществ.
Величины С в выражении для
называются равновесными и соответствуют
определенному состоянию системы, при
данной Т.
При изменении С одного из
в-в происходит смещение равновесия,
изменение С других в-в и установление
нового равновесия. Если Т при этом равно
const,
то величина
(
не зависят от C
и P.
Зависят от природы реагирующих
веществ.
Величины С в выражении для
называются равновесными и соответствуют
определенному состоянию системы, при
данной Т.
При изменении С одного из
в-в происходит смещение равновесия,
изменение С других в-в и установление
нового равновесия. Если Т при этом равно
const,
то величина
( остается неизменной.
Т.к. согласно
уравнению Клайперона-Менделеева P=CRT
связь между
и
остается неизменной.
Т.к. согласно
уравнению Клайперона-Менделеева P=CRT
связь между
и
 выражается уравнением:
выражается уравнением:
 ; R=0,083
; R=0,083
 ;
;
 ;
Где n’
и n’’
– число моль газа в ур-ии газа. Для
рассмотренной реакции
;
Где n’
и n’’
– число моль газа в ур-ии газа. Для
рассмотренной реакции

Физический смысл КС (КР): константа равновесия определяет глубину протекания процесса к моменту достижения системой равновесного состояния. Чем больше численное значение К, тем больше степень превращения исходных веществ в продукты реакции и, следовательно, тем c большей скоростью до достижения равновесия идет прямая реакция.
