
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
Зависимость скорости физико-химического процесса от температуры приближенно выражается правилом Вант-Гоффа: при увеличении температуры на каждые 10 градусов скорость большинства химических реакций возрастает примерно в 2 –4 раза. Математически эта зависимость выражается соотношением
|
|
где
 и
и
 –
cкорости реакции при температурах Т2
и Т1;
∆Т = Т2 – Т1;
–
cкорости реакции при температурах Т2
и Т1;
∆Т = Т2 – Т1;
γ – температурный коэффициент скорости (значения изменяются от 2 до 4), показывающий, во сколько раз увеличится скорость реакции с повышением температуры на 10 градусов. Численное значение γ зависит от природы реагирующих веществ и для данной реакции есть величина постоянная.
Увеличение скорости химической реакции с повышением температуры связано с возрастанием числа активных молекул, обладающих избыточной энергией. Избыточная энергия, которой должны обладать молекулы, чтобы столкновение было эффективным, называется энергией активации Еа. Численное значение Еа зависит от природы реагирующих веществ и катализатора. Чем больше значение Еа, тем меньше скорость химической реакции.
Функциональную зависимость скорости реакции от температуры выражает уравнение Аррениуса:
|
|
где
k – константа скорости; А –
постоянная величина для реакции,
характеризует
общее число столкновений с благоприятной
ориентацией, не зависит от температуры;
е – основание натурального логарифма;
Еа –
энергия активации, 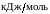 ;
R –
универсальная газовая постоянная; Т –
абсолютная температура, К.
;
R –
универсальная газовая постоянная; Т –
абсолютная температура, К.
Множитель е– Еа / RT, называемый экспоненциальным, характеризует долю активных столкновений (столкновений активных частиц) от их общего числа. Анализ уравнения Аррениуса показывает: при повышении температуры возрастает доля активных столкновений, объясняя экспоненциальную зависимость скорости реакции от температуры.
Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
Избыточная
энергия, которой должны обладать
молекулы, чтобы столкновение было
эффективным, называется энергией
активации Еа.
Численное значение Еа
зависит от природы реагирующих веществ
и катализатора. Чем
больше значение Еа,
тем меньше скорость химической реакции.
В химических взаимодействиях участвуют
частицы с энергией
 Частицы обладающие достаточным запасом
энергии называются активными, а их
столкновения эффективными.
Частицы обладающие достаточным запасом
энергии называются активными, а их
столкновения эффективными.
Следствие
из уравнения Аррениуса
 :
при увеличении температуры в большей
степени растет константа скорости той
реакции, энергия активации которой
больше.
:
при увеличении температуры в большей
степени растет константа скорости той
реакции, энергия активации которой
больше.
Зная
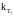 и
и
 ,
можно вычислить Еа
из соотношения
,
можно вычислить Еа
из соотношения
|
Одним из наиболее распространенных в практике способов изменения скорости процессов является катализ. При катализе реакция протекает через ряд промежуточных стадий, каждая из которых характеризуется определенным значением энергии активации: катализаторы уменьшают Еа, ингибиторы (замедлители) увеличивают Еа.
Энергетические диаграммы показывают изменения эн-ии систем в ходе физ-хим процессов.

Слева
рис1. Энергетическая диаграмма для
экзотермической р-ии
N2+3H2
= 2NH3,
 E’
– энергия активированного комплекса
системы, т.к. совокупности атомов(ионов),
между которыми ослаблены прежние и
образуются новые химические связи.
Состояние акт. комплекса является
неустойчивым.
Справа рис2. Энергетическая
диаграмма в присутствии катализатора.
В
присутствии катализатора, процесс
проходит через ряд промежуточных стадий,
энергия активации которых меньше, чем
энергия активации суммарного процесса.
Величина
E’
– энергия активированного комплекса
системы, т.к. совокупности атомов(ионов),
между которыми ослаблены прежние и
образуются новые химические связи.
Состояние акт. комплекса является
неустойчивым.
Справа рис2. Энергетическая
диаграмма в присутствии катализатора.
В
присутствии катализатора, процесс
проходит через ряд промежуточных стадий,
энергия активации которых меньше, чем
энергия активации суммарного процесса.
Величина
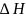 р-ии от катализатора не зависит.
р-ии от катализатора не зависит.
 ;
;
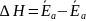

 или
или  ,
, или
или  ,
, или
или
 .
.