
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
Гидролиз по катиону. Подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2, FeSO4 и др.). Среда раствора кислая (pH < 7).
1. Запишем уравнение диссоциации соли и отметим природу электролитов, образующих соль:

катион слабого основания анион сильной
кислоты
2. Выбрав ион, способный гидролизоваться, запишем ионно-молекулярное уравнение гидролиза:
|
|
К
катиону
 из воды присоединяется ион
из воды присоединяется ион
 ,
образуя слабое основание
,
образуя слабое основание
 ;
в растворе возрастает концентрация
ионов водорода; среда становится кислой.
;
в растворе возрастает концентрация
ионов водорода; среда становится кислой.
3. Ионно-молекулярному уравнению соответствует молекулярное уравнение гидролиза:
 .
.
Константа гидролиза
( )
связана с
константой диссоциации (
)
связана с
константой диссоциации (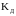 )
слабого электролита и ионным произведением
воды (
)
слабого электролита и ионным произведением
воды ( )
соотношением
)
соотношением
|
Для определения характера среды раствора (рН) в результате гидролиза по катиону используется соотношение
|
|
Гидролиз по аниону. Подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (K2CO3, Na2S, Na2SO3, K3PO4 и др.). Среда раствора щелочная (рH > 7).
Составим уравнение гидролиза соли KCN.
1. 
катион сильного основания анион слабой кислоты
2.  ,
,  ;
рН > 7.
;
рН > 7.
К
аниону
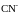 из воды присоединяется ион H+,
образуя слабую кислоту
из воды присоединяется ион H+,
образуя слабую кислоту
 ;
в растворе возрастает концентрация
ионов гидроксида
;
среда становится щелочной.
;
в растворе возрастает концентрация
ионов гидроксида
;
среда становится щелочной.
3.  .
.
При гидролизе
по аниону |
Для определения величины рН при гидролизе по аниону используется соотношение
|
а также уравнения (2.19) и (2,20). Значение рН рассчитывается, исходя из выражений
рОН = – |
|
Гидролиз по
катиону и аниону.
Если соль образована катионом слабого
основания и анионом слабой кислоты, то
гидролизу подвергается как катион, так
и анион. Характер среды определяется
сравнением констант диссоциации
образующихся слабых электролитов. В
случаях 

 раствор соответственно будет нейтральным,
кислым или щелочным.
раствор соответственно будет нейтральным,
кислым или щелочным.
Составим уравнение гидролиза соли NH4CN.
1. 
катион слабого основания анион слабой кислоты
2. 
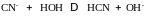
Оба процесса усиливают друг друга за счет связывания ионов H+ и в молекулы H2O, поэтому такие соли подвергаются гидролизу наиболее полно.
3. 
В данном случае
реакция раствора будет слабощелочной,
поскольку константа диссоциации
гидроксида аммония ( )
несколько больше константы диссоциации
синильной кислоты (
)
несколько больше константы диссоциации
синильной кислоты ( ),
т.е. основание более сильный электролит,
чем кислота.
),
т.е. основание более сильный электролит,
чем кислота.
При гидролизе
по катиону и аниону |
(2.24) |
Гидролиз
многозарядных ионов (Zn2+,
Fe3+,
Cu2+,
 ,
,
 ,
S2–
и др.) протекает ступенчато в связи со
ступенчатой диссоциацией образующихся
слабых электролитов.
,
S2–
и др.) протекает ступенчато в связи со
ступенчатой диссоциацией образующихся
слабых электролитов.
Гидролиз многозарядного катиона:
 (диссоциация
соли)
(диссоциация
соли)
1.  (1-я
ступень гидролиза);
(1-я
ступень гидролиза);
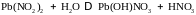
2.  (2-я
ступень гидролиза);
(2-я
ступень гидролиза);

Гидролиз многозарядного аниона:
 (диссоциация
соли)
(диссоциация
соли)
1.  (1-я
ступень гидролиза);
(1-я
ступень гидролиза);

2.  (2-я
ступень гидролиза);
(2-я
ступень гидролиза);

Каждая ступень гидролиза многозарядных ионов характеризуется своей константой гидролиза. Так, константы гидролиза двухзарядного аниона следующие:
|
где
 и
и
 –
константы диссоциации кислоты по 1-й и
2-й ступеням
–
константы диссоциации кислоты по 1-й и
2-й ступеням
Гидролиз солей, содержащих многозарядные ионы, протекает преимущественно по первой ступени и продуктами гидролиза являются основные соли (Pb(OH)NO3), если гидролизуется многозарядный катион; и кислые соли (NaHCO3), если гидролизуется многозарядный анион.
Глубина протекания гидролиза зависит от следующих факторов:
1) природа соли (сила электролитов, образующих соль). Чем слабее электролит, образующий соль (чем меньше его константа диссоциации), тем больше константа гидролиза и тем глубже протекает процесс;
2) температура. Гидролиз является эндотермическим процессом, поэтому с повышением температуры константа гидролиза увеличивается;
3) концентрация гидролизующейся соли. Из соотношения (2.18) следует, что уменьшение концентрации гидролизующейся соли (разбавление раствора) приводит к возрастанию степени гидролиза;
4) наличие одноименных ионов. Равновесие гидролиза подвижно и может быть смещено. Усилению гидролиза способствует выведение из сферы реакции продуктов гидролиза в виде слабых электролитов: в соответствии с принципом Ле Шателье гидролиз по катиону усиливается при добавлении в раствор соли основания; гидролиз по аниону – при добавлении в раствор кислоты. Ослаблению гидролиза способствует введение в сферу реакции одноименных, т.е. образующихся в результате реакции, ионов Н+ или ОН–.

 ,
, ;
;
 .
.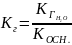 .
. ;
;

 ..
.. ,
, и
рН = 14 – рОН.
и
рН = 14 – рОН. .
. , КГ1 > КГ2,
, КГ1 > КГ2,