
- •Cодержание
- •Глава I. Внутриаптечный контроль лекарственных средств........... 8
- •Глава II. Общая характеристика II группы периодической системы Менделеева…………………………………………………………………...…21
- •Глава III. Лекарственные средства………………………………………....24
- •Глава IV.Практическая часть………………………………………………..46
- •Глава IV. Изготовление лекарственных форм и проведение внутриаптечного контроля……………………………………...46
- •Введение.
- •Глава I. Внутриаптечный контроль лекарственных средств.
- •I.1. Организация внутриаптечного контроля.
- •I.2. Контроль качества.
- •I.3. Приемочный контроль.
- •I.4. Письменный контроль.
- •I.5. Органолептический контроль.
- •I.6. Физический контроль.
- •I.7. Химический контроль.
- •1.8 Особые требования к контролю качества стерильных растворов.
- •Контроль при отпуске.
- •Глава II. Общая характеристика II группы периодической системы Менделеева.
- •Глава III. Лекарственные средства.
- •III.1. Cоединения магния
- •III.1.1. Магния оксид – Magnium oxydum
- •III.1.2. Магния сульфат – Magnesii sulfas
- •III.2. Соединения бария
- •III.2.1. Бария сульфат для рентгеноскопии –
- •III.3. Соединения кальция
- •III.3.1. Кальция хлорид – Calcii chloridum
- •III.4. Соединения цинка
- •III.4.1. Цинка сульфат – Zinci sulfas
- •III.4.2. Цинка окись – Zinci oxydum
- •III.5. Соединения ртути.
- •III.5.1. Ртути окись жёлтая – Hydrargyri oxydum flavum
- •Практическая часть
- •Глава IV. Изготовление лекарственных форм и проведение внутриаптечного контроля.
- •4.1 Внутриаптечный контроль магния сульфата.
- •4.2 Внутриаптечный контроль кальция хлорид.
- •5. Физический контроль
- •4.3 Внутриаптечный контроль цинка сульфата.
- •Заключение.
- •Список используемой литературы.
III.3. Соединения кальция
Кальций содержится в природе в виде минералов: СаСО3 (мел, известняк, мрамор), CaMg(C03)2 (доломит), CaS04-2H20 (гипс), а также CaS04 (ангидрит), Са3(Р04)2 (фосфорит), Ca5F(P04)3 (апатит), CaF2 (плавиковый шпат).
Ион кальция играет важную роль в организме. Этот элемент входит в состав зубной, костной, мышечной и нервной тканей.
Фармакопейными препаратами являются кальция хлорид (Приложение 1) и кальция сульфат. Из соединений кальция в медицине применяют также соли органических кислот, например, глицерофосфат кальция, кальция глюконат.
III.3.1. Кальция хлорид – Calcii chloridum
СаС12 ■ 6Н20
Получение.
Кальция хлорид, предназначенный для медицинских целей, обычно получают обработкой карбоната кальция соляной кислотой:
СаС03 + 2НС1 = СаС12 + Н20 + С02↑
Очистку от примесей магния и железа проводят в соответствии с реакциями:
2FeCl3 + ЗСа(ОН)2 = 2Fe(OH)3↓ + ЗСаС12
MgCl2 + Са(ОН)2 = Mg(OH)2↓ + СаС12
Свойства.
Бесцветные призматические кристаллы, без запаха, горько-солёного вкуса. Легко растворим в воде, спирте. Гигроскопичен, на воздухе расплавляется, превращаясь в жидкость. Учитывая гигроскопичность, в аптеке готовят 50% концентрат, а далее из него растворы нужной концентрации.
Определение подлинности.
Подлинность препарата определяют по катионам кальция и хлоридов.
ГФ – на ионы кальция пирохимическим способом. Соли кальция окрашивают пламя горелки в кирпично-красный цвет.
ГФ – на ионы кальция. К препарату добавляют оксалат аммония. Образуется белый кристаллический осадок, растворимый в минеральных кислотах и не растворимый в уксусной кислоте.
(NH4)2C204 + СаС12 = СаС204↓ + 2NH4C1
ГФ – на хлорид- ионы. К препарату добавляют нитрат серебра. В результате образуется белый творожестый осадок хлорида серебра.
CaCl2 + 2AgNO3 = 2AgCl↓ + Ca(NO3)2
на ионы кальция - реакции образования белого осадка CaS04 при обработке препарата серной кислотой или сульфатами щелочных металлов:
СаС12 + H2S04 = CaS04↓ + 2НС1
СаС12 + Na2S04 =CaS04↓ + 2NaCl
Ионы кальция в растворе могут быть определены с помощью ионоселективных электродов.
Испытания на чистоту.
В препарате не допускаются примеси растворимых солей бария, железа, алюминия, фосфатов. Допустимыми примесями являются примеси сульфатов, тяжелых металлов, мышьяка, солей магния.
При испытании на ионы железа, алюминия и фосфата к раствору (1 г в 20 мл воды) добавляют 2 капли соляной кислоты концентрации 3 моль/л и 1 каплю фенолфталеина, затем аммиачный буфер, пока раствор не примет розовую окраску, и нагревают его до кипения. Не должно наблюдаться помутнения или образования осадка гидроксидов или фосфатов. Кроме того, контролируются примеси магния и щелочных металлов, а также летучие органические примеси.
Кальция хлорид для инъекций имеет рН 5,5 — 7,5. Для него обязателен контроль содержания бактериальных эндотоксинов.
Кальция сульфат жженый CaS04- 1/гН20 (2CaS04- Н20)
При нагревании гипса выше 150 °С теряется вся кристаллизационная вода. Такой гипс называется пережженным, он теряет способность «схватываться», т.е. присоединять воду.
Гипс испытывают на затвердевание. Для этого смешивают 10 частей гипса с 5 частями воды. Затвердевание («схватывание») смеси должно произойти не ранее, чем через 4 мин, и не позднее, чем через 10 мин.
Количественное определение.
ГФ методом количественного определения кальция хлорида в препарате является комплексонометрический метод с индикатором кислотным хромовым темно-синим (2-(2-оксифенилазо)-1,8-диоксинафталин-3,6-дисульфокислота; относится к группе азокрасителей):
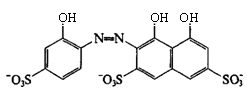
Индикатор реагирует с Са2+ в щелочной среде с образованием вишнево-красного комплексного соединения. При титровании раствором трилона Б в точке эквивалентности происходит изменение окраски раствора на сине-сиреневую (см. пояснения в подраздел 3.2).
Кроме того, в качестве индикатора применяют кальконкарбоновую кислоту (каль-цес, 1-(2-окси-4-сульфо-1-нафтиталазо)-2-окси-3-нафтойная кислота, относится к группе азокрасителей):

Комплекс индикатора с кальцием окрашен в красно-сиреневый цвет. В точке эквивалентности окраска изменяется на голубую.
Содержание кальция хлорида в препарате должно быть не менее 98,0 %.
Фотометрические методы определения кальция основаны на применении специальных органических реактивов, образующих цветные комплексы с солями кальция.
Люминесцентные методы определения кальция основаны на применении соединений (например, флюорексона), которые с солями кальция в растворах образуют флюоресцирующие комплексы.
Кальция хлорид можно количественно определить и по аниону аргентометрическим методом:
СаС12 + 2AgN03 = 2AgCl↓ + Ca(N03)2
Применение.
Применяют при недостаточности функции паращитовидных желез, сопровождающейся тетанией или спазмофилией; при аллергических заболеваниях (бронхиальная астма, крапивница, сенная лихорадка) в основном для снятия зуда; как кровоостанавливающее средство при легочных, желудочно-кишечных, носовых и маточных кровотечениях. В хирургической практике для повышения свёртываемости крови в послеоперационный период. При усиленном удалении из организма ионов кальция (рахит, остеопороз), при воспалительном заболевании для уменьшения проницаемости сосудов. Как противоядие при отравлениях солями магния. Препарат также используют в сочетании с другими средствами для стимулирования родовой деятельности.
Форма выпуска.
Порошок, растворы 5%, 10% во флаконах по 100 и 250 мл; 2,5% раствор для инъекций в ампулах по 5 и 20 мл и 10% - по 2, 5 и 10 мл. Вводят внутривенно, внутримышечно и подкожно нельзя ,т.к вызывает некроз.
Хранение.
Хорошо закупоренные склянки оранжевого стекла или светлого. Пробку заливают парафином. Хранят в сухом месте.
