
- •Лекція №14. Поверхневі явища. Адсорбція на межі поділу рухомих фаз
- •За здатністю молекул пар до іонізації їх поділяють на класи:
- •Іоногенні колоїдні пар:
- •Лекція №15. Адсорбція на твердому адсорбенті
- •Теорія мономолекулярної адсорбції (Ленгмюр, 1915):
- •Адсорбція на межі тверде тіло ‑ розчин
- •Лекція №16. Застосування адсорбції
- •Застосування адсорбції
- •Лекція №16. Дисперсні системи. Колоїдні розчини. Методи добування та очищення
- •Грубодисперсні системи
- •Загальна характеристика
- •Очищення колоїдних розчинів
- •Лекція №17. Будова колоїдних частинок. Стійкість колоїдних розчинів. Коагуляція
- •Механізми утворення пеш
- •Стійкість колоїдних розчинів
- •Між колоїдними частинками діють дві взаємно протилежні сили:
- •Стійкість дисперсної системи
- •У цукровій промисловості при очищенні соку цукрового буряка (дифузійний сік)
- •Лекція №18. Властивості колоїдних розчинів
- •Рівняння Релея (теорія світлорозсіювання для сферичних непоглинаючих світло частинок, 1871р.)
- •Визначення концентрації спирту в розчині
- •Конденсаційні методи.
- •Диспергаційні методи.
- •Тип емульсії визначають:
- •Методи одержання емульсій
- •Емульгування ‑ одержання емульсій шляхом диспергування однієї рідини в іншій струшуванням, інтенсивним перемішуванням. Емульгуванню сприяють:
- •Високомолекулярні сполуки класифікують:
- •І За походженням
- •Іі. За формою макромолекул
- •Склоподібний стан
- •Кристалічний стан
- •В’язко-текучий стан
- •Залежність властивостей некристалічних полімерів від температури
- •Властивості полімерів:
- •Властивості розчинів вмс:
- •Властивості розчинів вмс:
- •Властивості розчинів вмс
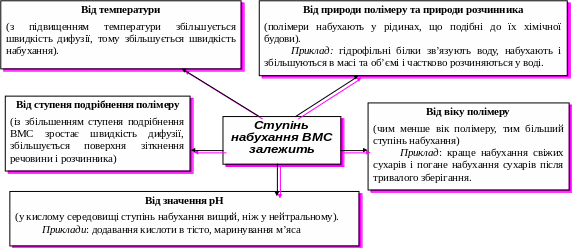
- •Кількісні характеристики процесу набухання
- •Тиск набухання
- •Ступінь набухання (α)
- •Форми існування води у полімерах
- •Лекція №21. Високомолекулярні сполуки – важлива складова частина продуктів харчування
- •Зміна колагену при тепловій обробці
- •Основні зміни, що відбуваються з білками при їх нагріванні
- •Зміни вуглеводів у технологічних процесах
- •Способи уповільнення реакції меланоїдиноутворення:
- •Зміни кольору та формування смако-ароматичного комплексу при тепловій обробці продуктів
- •Роль білків і крохмалю у хлібопекарському виробництві
- •Речовини, які змінюють структуру і фізико-хімічні властивості харчових продуктів
Кількісні характеристики процесу набухання

Якщо вихідну масу
полімеру помістити у щільно закриту
посудину з поруватим днищем, то під час
дифузії молекул розчинника у середину
полімеру та збільшення об’єму в системі
виникає тиск.
Р
= max
- на початку
набухання (десятки і сотні атмосфер);
Р↓ ‑ протягом
набухання;
Р = 0 – при досягненні
рівноваги між ВМС і розчинником.
Фізична природа
набухання аналогічна явищу осмосу.
Тиск
набухання
можна розглядати як осмотичний тиск у
насиченому розчині ВМС, а набухаючий
полімер – осмотична чарунка, куди
проникають молекули низькомолекулярної
рідини.Тиск набухання
(здатність
полімеру до набухання у різних середовищах
за різних умов).
Свідчить про
відносне збільшення маси ВМС.
m0–
маса ВМС
до набухання; m
– маса ВМС після набухання; mр
– маса розчинника, яку поглинув полімер.
α
(білка) = 200%; α (крохмалю) <
10%.Ступінь набухання (α)
![]() ,
або
,
або
![]()

Вільна
вода (капілярна)
як середовищеФорми існування води у полімерах


Зв’язана
вода (гідратаційна)
має обмежену рухомість (чим вищі
гідрофільні властивості ВМС, тим більше
зв’язаної води). Зв’язана вода відіграє
головну роль у набуханні. Так, білки
борошна при замішуванні та бродінні
тіста поглинає і утримує більше200% води
по відношенню до їх маси. При гідратації
полярних груп білкових макромолекул
поглинається близько ¼ всієї
маси
поглинутої води.
Інша
кількість зв’язаної води визначає
набухання білків з утворенням клейковини.

Коацервація – розшарування розчинів ВМС при нагріванні або збільшенні концентрації, пов’язане із формуванням асоціатів молекул і виділенням утвореної фази за рахунок злиття дрібних капель. В результаті коацервації система розділяється на дві фази: розчин ВМС в розчиннику і розчинник у ВМС (коацерват). Коацервація відбувається при зміні температури або складу розчину. Обумовлена зниженням взаємної розчинності компонентів розчину.
Коацервація спостерігається у водних розчинах желатину при додаванні спирту або сульфату натрію; у розчинах деяких білків, що добре розчиняється у спирті, внаслідок додавання води. При рН = 1,2 – 4,8 макромолекули желатину позитивно заряджені; при додаванні до такого розчину білка гуміарабіку з негативно зарядженими макромолекулами відбувається нейтралізація зарядів і розчинність желатину зменшується – в системі відбувається коацервація.
Розрізняють:
комплексну коацервації (взаємодіють два ВМС);
просту коацервації (взаємодіють ВМС і низькомолекулярна сполука) – спирт і желатин.
Драглювання. Розчини ВМС та деякі колоїдні системи здатні за певних умов втрачати текучість і застигати, утворюючи драглі. В драглях частинки дисперсної фази зв’язані між собою у сітчастий каркас, дисперсійне середовище міститься в проміжках між ними.
Драглі ‑ це структуровані системи з властивостями еластичних твердих тіл. Драглеподібний стан речовини можна розглядати як проміжний між рідким та твердим станом.
Приклади драглів: харчові продукти (хліб, м’ясо, джем, желе, мармелад, кисіль, кисле молоко; нехарчові продукти (клей, каучук); драглеподібні осади гідроксидів феруму (ІІІ), алюмінію, оксиду силіцію (ІV).

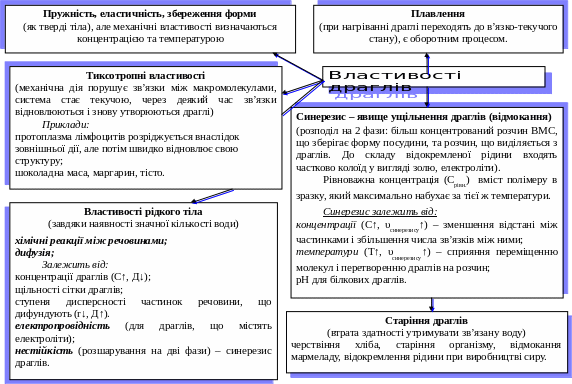
Особливість драглів – вміст речовини, що утворює чарунку драглів, ‑ незначний порівняно з масою драглів. Наприклад, у водних драглях вміст води іноді перевищує 99%. За такої структури дифузія драглів при стиканні з розчином відбувається швидко як в чистій воді.
Відмінність дифузії в драглях від дифузії в рідинах полягає у відсутності перемішування і відсутності утворення конвекційних токів, що виникають у рідких розчинах. Як результат: у сусідніх ділянках драглів незалежно одна від одної можуть проходити хімічні реакції.
Коефіцієнт дифузії в драглях незначно відрізняється від коефіцієнту дифузії в чистому дисперсійному середовищі.
На швидкість дифузії іонів у драглях впливають:
концентрація драглів – малі за розмірами молекули та іони дифундують швидко за умови відсутності взаємодії між іонами та ВМС драглів;
розмір частинок, що дифундують – чим нижчий ступінь дисперсності частинок, тим нижча швидкість їх дифузії в драглях. Великі частинки практично нездатні до дифузії. На цій властивості базується драглеподібних напівпроникних мембран. Швидкість дифузії високодисперсних колоїдних систем, розчинів напівколоїдів і ВМС залежить від частоти сітки драглів і розміру дифундуючи частинок;
природи дифундуючої речовини. Наприклад, в технології хлібопекарського виробництва харчові добавки сіль, цукор дифундують у желеподібні колоїди напівфабрикатів, впливають на їх гідрофільність, ступінь набухання.
Електрична провідність драглів залежить від здатності до дифузії іонів у дисперсійному середовищі: чим більша швидкість дифузії іонів у драглях, тим вища електрична провідність драглів. Наприклад, агар-агар використовують у гальванічних елементах.
У драглях можливі реакції осадження, але швидкість їх набагато нижча, ніж у рідкому середовищі. В результаті реакцій осадження осади виділяються окремими кільцями, розділеними прозорими проміжками драглів (кільця Лізеганга, 1896р.).
Драглювання та драглі широко застосовуються у:
виробництві віскозного, ацетатного, мідноаміачного шовку; різних типів штучної шкіри, гумових виробів з синтетичного латексу і розчинів каучуків, матеріалів з пластифікованих полімеризаційних пластиків;
у хлібопеченні, сироварінні, кондитерському виробництві, консервуванні плодів і ягід, виготовленні страв – драглеутворення є однією з стадій технологічного процесу (пектинові речовини, агар-агар, агароїд, желатин).
Пектинові речовини можуть утворювати драглі у водних розчинах тільки в присутності цукру і кислоти. Чим більший вміст пектину, тим більшу кількість цукру необхідно додавати для утворення драглів. Від надлишку цукру продукт стає еластичнішим, на зламі більш крупнозернистим, але слабкішим (цукор ‑ дегідратуюча речовина). Кислота витісняє іони металу з солей пектину. Частково звільнені від іонів металу карбонільні групи слабкої пектинової кислоти утворюють міжмолекулярні водневі зв’язки, за рахунок яких утворюється структурний каркас, всередині якого знаходиться розчин сахарози і кислоти. Завдяки цьому підвищуються драглеутворюючі властивості пектинового розчину і поліпшується якість драглів.
У виробництві харчових продуктів широке використання знаходять гідрофільні властивості білків, тобто їх здатність до набухання і утворення драглів; стабілізації суспензій, емульсій і пін. Сильно гідратовані драглі – сира клейковина, що виділена з пшеничного тіста, містить близько 65% води. Гідрофільність клейковинних білків – одна з ознак, що характеризують якість зерна пшениці та борошна з неї.
Живі організми складаються з драглів різного ступеня обводнення. Тіло медузи є драглями з великим ступенем обводнення (до 90% води), а рогова тканина містить дуже мало води (десяту частку відсотка). Кістки мають деяку пружність та еластичність завдяки драглистій речовині – осеїну. З віком кістки стають більш крихкими тому, що в них збільшується вміст твердих мінеральних речовин. М’ясо молодих тварин більш соковите, ніж старих: з віком тканини тварин внаслідок синерезису та дегідратації втрачають здатність утримувати воду, стають більш твердими, сухими.
Харчові продукти (хліб, м’ясо, джем, желе, мармелад, кисіль, кисле молоко, різні сорти сиру) – драглі різного ступеня обводнення; Білки яйця – концентровані колоїдні розчини (золі), в результаті денатурації утворюють гель, здатний утримувати воду. Білки зернобобових знаходяться у вигляді сухих гелів, алейронових зерен. При тепловій обробці зернобобових відбувається набухання білків, виділення рідини (збільшення маси бобових, круп, утворення клейковини борошна), яка не переходить в середовище, так як зразу поглинається крохмалем (клейстеризація);
Крохмальні золі та гелі є основою для виготовлення киселів різної в’язкості. Залежно від співвідношення крохмалю і води одержують. Крохмальні золі – основа киселів рідкої і середньої консистенції (ω крохмалю =2-5%), солодких супів, соусів (ω=2%). Клейстер у вигляді гелю утворюється, якщо крохмальні пухирці тісно зв’язані між собою внаслідок майже повного поглинання ними води. Утворюються щільні гелі в киселях (ω крохмалю 6-8%), при варінні круп, бобових, макаронних виробів, картоплі, коли крохмаль поглинає максимальну кількість води.
При зберіганні у холодному стані виробів і страв, що місять оклейстеризований крохмаль, відбувається зменшення вмісту розчиненої амілози, що викликає зниження вмісту розчинних речовин, і вироби черствіють.
Старіння або синерезис крохмальних золів (гелів) спостерігається в кашах, макаронних стравах через дві години після приготування (частково зворотний); в киселях (не зворотний);
черствіння хліба та хлібобулочних виробів. На перших стадіях черствіння хліба маса його не змінюється. Отже, черствіння відбувається не за рахунок випаровування води. Оклейстеризований крохмальний гель «відмокає», з нього виділяється вода і сам він стає твердим. При нагріванні зачерствілого хліба відбувається часткове повернення втраченої свіжості, що свідчить про оборотність процесу синерезису в драглях типових органічних ВМС.
при „відмоканні” мармеладу, желе, фруктових джемів, карамелі; при виробництві молочного сиру (відокремлення сироватки);

