
- •І.С.Боровик Фізична та колоїдна хімія Збірник задач
- •1. Термодинаміка. Термохімія
- •1.1. Обчислення теплових ефектів реакцій (ентальпій реакцій), ентальпій утворення речовин Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі Тема: Термодинаміка. Термохімія
- •2. Агрегатні стани речовини
- •Методичні рекомендації по розв’язуванню задач
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2.2. Обчислення поверхневого натягу і в’язкості рідин Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •2.3. Застосування правила фаз Гіббса*
- •Задачі для розв’язування
- •Відповіді на задачі
- •3. Хімічна кінетика. Хімічна рівновага
- •Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •3.2. Обчислення в стані хімічної рівноваги Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •4. Істинні розчини
- •4.1. Обчислення осмотичного тиску, зниження температури замерзання і підвищення температури кипіння розчинів неелектролітів Теоретичні положення
- •Методичні рекомендації по розв’язуванню задач
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •4.2. Обчислення осмотичного тиску, температур замерзання та кипіння розчинів, констант дисоціації, уявного ступеня дисоціації розчинів електролітів Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення pH розчинів сильних електролітів Теоретичні положення
- •Відповіді на задачі
- •ДИсперсні системи. Колоїдні розчини
- •5.1. Складання формули міцели колоїдного розчину Теоретичні положення
- •Задача №1
- •Розв’язування:
- •Задача №2
- •Розв’язування:
- •5.2. Обчислення порогів коагуляції колоїдних розчинів Теоретичні положення
- •Розв’язування: Записуємо формулу для обчислення пк золю:
- •Розв’язування:
- •Записуємо формулу для розрахунку порогу коагуляції золю:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Література
Відповіді на задачі
Тема: Істинні розчини
|
|
Відповідь: осм= 5,67 105 Па |
|
|
Відповідь: М = 52,93 г/моль |
|
|
Відповідь: осм= 2,6 106 Па |
|
|
Відповідь: tзам.=-27о С |
|
|
Відповідь: М = 152,74 |
|
|
Відповідь: tзам.= ‑ 47,6о С |
|
|
Відповідь: осм=2,521 · 105 Па |
|
|
Відповідь: М =342 г/моль |
|
|
Відповідь: m = 86,5г |
|
|
Відповідь: tкип.=100,08оС |
|
|
Відповідь: М =61,9 |
|
|
Відповідь: См= 1,23 · 10-3моль/л |
|
|
Відповідь: = 2,49 · 10-4 |
|
|
Відповідь: М=256,4; сірка асоційована, її молекула складається з 8 атомів |
|
|
Відповідь: Тзам.=271,34К, Ткип= 373,67К |
|
|
Відповідь: 1,48 К г/моль |
|
|
Відповідь: m (C6H12O6) = 11,3г |
|
|
Відповідь:
|
|
|
Відповідь: М = 7,36 104г/моль |
|
|
Відповідь: М = 30 |
|
|
Відповідь: уявн = 87,6% |
|
|
Відповідь: рН= 12 |
|
|
Відповідь:
|
|
|
Відповідь:
|
|
|
Відповідь: tзам= ‑ 0,3720С, tкип= 100,1040С |
|
|
Відповідь: tзам = ‑ 0,830С |
|
|
Відповідь:
|
|
|
Відповідь: М = 342 |
|
|
Відповідь: tкип = 81,260С |
ДИсперсні системи. Колоїдні розчини
5.1. Складання формули міцели колоїдного розчину Теоретичні положення
Міцела – це структурна колоїдна частинка дисперсної фази.
При змішуванні розведених розчинів нітрату срібла та хлориду натрію, взятого у надлишку, хлорид срібла не випадає в осад, а утворює колоїдний розчин.
Спочатку складаємо рівняння реакції в молекулярному та іонному виглядах:
AgNO3 + NaCl → NaNO3 + AgCl
Ag+ + NO3- + Na+ + Cl- → Na+ + NO3- + AgCl
Ag+ + Cl- → AgCl
Основу колоїдних частинок золю AgCl становлять мікрокристали важкорозчинного хлориду срібла, які називаються агрегатами, позначаються m (AgCl)
Ця реакція відбувається при наявності надлишку хлориду натрію, внаслідок вибіркової адсорбції іонів Сl-, на поверхні агрегату виникає негативно заряджений шар з хлорид-іонів.
Cl- називаються потенціалвизначальними іонами.
Агрегат разом з потенціалвизначальними іонами, які міцно адсорбувались і увійшли у кристалічну гратку агрегату, є частинкою твердої фази – ядра.
Позначення: { m (AgCl) n Cl-
Зверніть увагу на те, що потенціалвизначальними іонами можуть бути іони, які добудовують кристалічну решітку агрегату або містяться у складі агрегату.
Під дією електростатичних сил до поверхні ядра притягуються іони протилежного знаку – протиіони. У даному випадку ‑ це іони Na+.
{ m (AgCl) n Cl- (n – x) Na+
А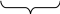 дсорбційний
шар
дсорбційний
шар
Агрегат, ядро, адсорбційний шар утворюють гранулу. Заряд гранули визначається знаком заряду потенціалвизначальних іонів (Сl-), позначається в правому верхньому куті.
Гранула має вигляд:
{ m (AgCl) n Cl- (n – x) Na+ }х-
Оскільки концентрація протиіонів біля поверхні більша, ніж у розчині, то решта протиіонів Na+ слабше зв’язана з ядром і під впливом теплового руху дифундує в бік з меншою концентрацією, утворюючи дифузійний шар протиіонів.
{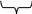 m (AgC ) n Cl-
(n – x)
Na+
}х-
x
Na+
m (AgC ) n Cl-
(n – x)
Na+
}х-
x
Na+
дифузійний шар
Гранула разом з дифузійним шаром утворює міцелу. Міцели золів електронейтральні.
Формула міцели:
{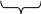
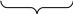 m (AgCl) n Cl-
(n – x)
Na+
} х-
x
Na+
m (AgCl) n Cl-
(n – x)
Na+
} х-
x
Na+
а грегат
адсорбційний шар дифузійний шар
грегат
адсорбційний шар дифузійний шар
 ядро
ядро
гранула
m ‑ кількість молекул, що входять до складу агрегату;
n ‑ кількість потенціалвизначальних іонів;
(n – х) ‑ кількість протиіонів, що входять в адсорбційний шар;
х ‑кількість протиіонів, що входять в дифузійний шар.
Завдання №1
Скласти формулу міцели золю, утвореного при змішуванні розведених розчинів сульфату цинку та сульфіду амонію, якщо сульфат цинку був узятий у надлишку.
Вирішення:
При змішуванні розведених розчинів сульфату цинку та сульфіду амонію, якщо один з розчинів реагентів узятий у надлишку, сульфід цинку не випадає в осад, а утворює колоїдний розчин.
Спочатку складаємо рівняння реакції в молекулярному та іонному виглядах:
ZnSO4 + (NH4)2S ZnS + (NH4)2SO4
Zn2+ + SO42- + 2NH4+ + S2- ZnS + 2NH4+ + SO42-
Zn2+ + S2- ZnS
Основу колоїдних частинок золю ZnS становлять мікрокристали важкорозчинного ZnS, які називаються агрегатами, позначаються: m (ZnS).
За умов надлишку ZnSO4:
Ядром колоїдних частинок золю ZnS адсорбуються переважно іони Zn2+- , тому що вони входять до складу осаду ZnS (агрегат) також іони цинку визначають заряд гранули (2х+). Вони називаються потенціалвизначальними іонами. До них за допомогою сил електростатичного притягання притягуються іони протилежного знаку – протиіони (сульфат-іони).
Міцела має вигляд:
{ m (ZnS) n Zn2+- (n – x) SO42- }2х+ x SO42-


 агрегат адсорбційний шар дифузійний
шар
агрегат адсорбційний шар дифузійний
шар
ядро
 гранула
гранула
За умов надлишку (NH4)2S міцела має вигляд:
{ m (ZnS) n S2-- 2(n – x) NH4+- }2х- 2x NH4+
агрегат адсорбційний шар дифузійний шар
ядро
гранула
Ядром колоїдних частинок золю ZnS адсорбуються переважно іони S2-, тому що вони входять до складу осаду ZnS (агрегат) також сульфід-іони визначають заряд гранули (2х-). Вони називаються потенціалвизначальними іонами, за допомогою сил електростатичного притягання до них притягуються іони протилежного знаку – протиіони (катіони амонію).
