
- •І.С.Боровик Фізична та колоїдна хімія Збірник задач
- •1. Термодинаміка. Термохімія
- •1.1. Обчислення теплових ефектів реакцій (ентальпій реакцій), ентальпій утворення речовин Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі Тема: Термодинаміка. Термохімія
- •2. Агрегатні стани речовини
- •Методичні рекомендації по розв’язуванню задач
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2.2. Обчислення поверхневого натягу і в’язкості рідин Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •2.3. Застосування правила фаз Гіббса*
- •Задачі для розв’язування
- •Відповіді на задачі
- •3. Хімічна кінетика. Хімічна рівновага
- •Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •3.2. Обчислення в стані хімічної рівноваги Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Задачі для розв’язування
- •Відповіді на задачі
- •4. Істинні розчини
- •4.1. Обчислення осмотичного тиску, зниження температури замерзання і підвищення температури кипіння розчинів неелектролітів Теоретичні положення
- •Методичні рекомендації по розв’язуванню задач
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •4.2. Обчислення осмотичного тиску, температур замерзання та кипіння розчинів, констант дисоціації, уявного ступеня дисоціації розчинів електролітів Теоретичні положення
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •Обчислення pH розчинів сильних електролітів Теоретичні положення
- •Відповіді на задачі
- •ДИсперсні системи. Колоїдні розчини
- •5.1. Складання формули міцели колоїдного розчину Теоретичні положення
- •Задача №1
- •Розв’язування:
- •Задача №2
- •Розв’язування:
- •5.2. Обчислення порогів коагуляції колоїдних розчинів Теоретичні положення
- •Розв’язування: Записуємо формулу для обчислення пк золю:
- •Розв’язування:
- •Записуємо формулу для розрахунку порогу коагуляції золю:
- •Задачі для розв’язування
- •Відповіді на задачі
- •Література
Розв’язування:
Хімічна реакція: N2 + 3H2 2NH3
Запишемо вираз константи рівноваги даної хімічної реакції:
Крівн.
=

Звідси знаходимо рівноважну концентрацію азоту:
[N2]
=
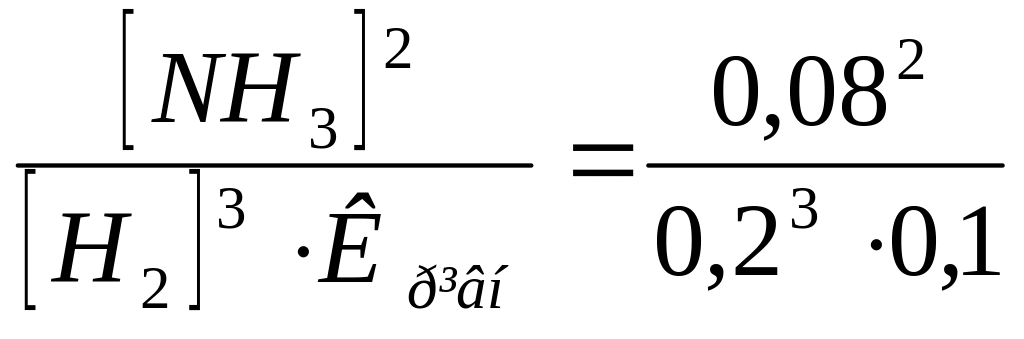 = 8 моль/л
= 8 моль/л
Обчислимо кількість моль азоту, що вступив в реакцію з воднем з утворенням 0,08моль аміаку, за рівнянням хімічної реакції:
![]() ;
;
х
= n(N2) =
![]()
Вихідна концентрація азоту дорівнює:
Cвих (N2) = n(N2) + [N2]
Після підстановки чисельних значень, одержимо:
Cвих (N2) = 0,04 + 8 = 8,04моль/л
Відповідь: Cвих (N2) = 8,04моль/л; [N2] = 8 моль/л
Приклад 1
Визначити, у який бік зміститься рівновага, якщо 1) у рівноважну суміш водню, азоту та аміаку додати азоту; 2) за рівноважного стану реакції С + СО2 2СО збільшити тиск; 3) підвищити температуру при проведенні реакції СО + СІ2 СОСІ2, ΔН=‑123кДж.
Відповідь:
рівновага зміститься у бік синтезу аміаку (пряма реакція) тому, що зростає концентрація однієї з реагуючих речовин, згідно принципу Ле Шательє рівновага зміщується у бік прямої реакції (утворення аміаку) при збільшенні концентрації реагенту та зменшенні концентрації продукту.
Рівновага зміститься вліво у бік зворотної реакції (число частинок газуватих речовин зменшується, що зумовлює зниження загального тиску). Пряма реакція відбувається із збільшенням об’єму, згідно принципу Ле Шательє збільшення тиску в реакціях, що супроводжуються збільшенням об’єму, спричиняє зміщення рівноваги у бік зворотної реакції (вліво).
Рівновага зміститься вліво, тому що пряма реакція відбувається з виділенням теплоти (екзотермічна реакція), згідно принципу Ле Шательє при підвищенні температури рівновага зміщується у бік зворотної реакції (вліво).
Задачі для розв’язування
Як зміниться швидкість прямої реакції N2 + 3Н2 ↔ 2NН3 при зменшенні об’єму газової суміші в 2 рази.
У скільки разів необхідно збільшити тиск, щоб швидкість утворення NO2 за реакцією 2NO + О2 ↔ 2NO2 зросла в 1000 разів.
Константа швидкості реакції першого порядку дорівнює 4,5∙10–5 с-1, початкова концентрація реагенту становить 1,6моль/л. Обчислити початкову швидкість реакції.
Реагенти А і В з початковою концентрацією кожного 0,2моль/л беруть участь у реакції другого порядку. Чому дорівнює константа швидкості цієї реакції, якщо її початкова швидкість 1,6∙10–4моль/(л∙с)?
Назвати порядок реакції, обчислити константу швидкості, якщо рівняння швидкості має вигляд υ=κ∙[А]∙[В]2, а υ=0,036моль/л∙год, [А]=0,37моль/л і [В]=1,26моль/л.
У скільки разів зростатиме константа швидкості хімічної рівноваги при підвищенні температури на 400С, якщо температурний коефіцієнт реакції дорівнює 3,5?
Обчислити, як зміниться швидкість реакції 2NO + О2 → 2NO2 внаслідок збільшення тиску втричі?
Як збільшиться швидкість реакції при підвищенні температури з 10 до 1000С, якщо при нагріванні на кожні 100С швидкість подвоюється?
Обчислити швидкість осадження карбонату кальцію з розчину, якщо за 5хв. від початку реакції утворилось 10г осаду в 100мл реакційного об’єму.
У скільки разів збільшиться швидкість реакції Н2 + І2 ↔ 2НІ, якщо збільшити кількість речовини йоду та водню в реакційній системі удвічі при постійному об’ємі.
Записати вирази для констант рівноваги ендотермічних оборотних реакцій:
а) СО2 + С ↔ 2СО;
б) Fe3O4 + 4H2 ↔ 3Fe + 4Н2О.
Вказати напрямок зміщення рівноваги при підвищенні температури, тиску.
При температурі 20000С константа рівноваги реакції N2 + О2 ↔ 2NO дорівнює 6,0∙10–4. Обчислити рівноважну концентрацію оксиду нітрогену, якщо початкові концентрації азоту та кисню становлять відповідно 0,1 і 0,02моль/л.
Рівноважні концентрації речовин у системі 2А + В ↔ 2С + D дорівнюють: [А]=2моль/л, [В] = 1моль/л, [С] = 1,6моль/л. Обчислити початкові концентрації цих речовин.
У який бік зміститься рівновага реакцій:
а) N2 + 3H2 ↔ 2NH3, ∆Н = ‑ 92,18 кДж;
б) N2O4 ↔ 2NO2, ∆Н = 56,98 кДж;
в) N2 + O2 ↔ 2NO, ∆Н = 181,0кДж при зниженні температури й тиску?
У якому напрямі зміниться рівновага системи
Н2 + S ↔ H2S, а) якщо збільшити концентрацію водню; б) якщо зменшити концентрацію сірководню?
Константа рівноваги гомогенної системи:
СО(г) + Н2О(г) СО2 (г) + Н2 (г) при деякій температурі дорівнює 1. Обчислити рівноважну концентрацію всіх реагуючих речовин, якщо вихідні концентрації СО та Н2О відповідно дорівнюють 0,1моль/л та 0,4моль/л.
Як зміниться швидкість прямої реакції
СО2 + С 2СО внаслідок зменшення концентрації СО2 у чотири рази. Записати вираз константи рівноваги.
