
- •2.Примеры расчёта эквив. Элемента, оксида, основания, соли, кислоты, ок-ля, вос-ля.
- •3.Основные термодинам. Хар-ки. 1,2,3 законы
- •4.Энергия Гиббса. Направленность самопроизвольных химических реакций.
- •9.Химическое равновесие с точки зрения термодинамики. Константа равновесия.
- •10.Смещение химического равновесия. Принцип Ле Шателье.
- •11.Агрегатные состояния. Растворы: понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
- •Вопрос 12.
- •13.Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях.
- •14.Давление пара растворителя над раствором. Закон Рауля.
- •15. Кипение и замерзание растворов неэлектролитов.
- •16.Отклонение поведения растворов электролитов и неэлектролитов. Изотонический коэффициент.
- •17.Слабые электролиты. Степень диссоциации. Константа диссоциации.
- •18.Зависимость степени диссоциации слабого электролита от концентрации раствора. Закон разбавления Оствальда.
- •19.Равновесие в растворах слабых электролитов. Влияние одноименного и связывающего ионов.
- •20.Амфотерные гидроксиды с точки зрения теории электролитической диссоциации.
4.Энергия Гиббса. Направленность самопроизвольных химических реакций.
Энергия
Гиббса - это величина, показ-ая изменение
энергии в ходе хим.реакции и дающая
ответ на принципиальную возможность
хим. реакции. G=H-T*S,
![]() G=
H-T*
S
G=
H-T*
S
![]()
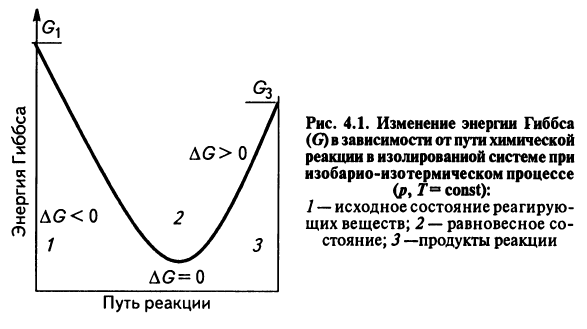

Полученное значение ΔG является критерием самопроизвольного течения реакции в прямом направлении, если ΔG < 0. Химическая реакция не может протекать самопроизвольно в прямом направлении, если энергия Гиббса системы возрастает, т.е. ΔG > 0. Если ΔG = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима.
Направление химических реакций зависит от их характера. Так, условие ΔG < 0 соблюдается при любой температуре для экзотермических реакций (ΔН < 0), у которых в ходе реакции возрастает число молей газообразных веществ, и, следовательно, энтропия (ΔS > 0). У таких реакций обе движущие силы (ΔН) и (ТΔS) направлены в сторону протекания прямой реакции и ΔG < 0 при любых температурах. Такие реакции являются необратимыми.
Наоборот, эндотермическая реакция (ΔН > 0), в результате которой уменьшается число молей газообразных веществ (ΔS < 0) не могут протекать самопроизвольно в прямом направлении при любой температуре, т.к. всегда ΔG > 0.
Если в результате экзотермической реакции (ΔН < 0) уменьшается число молей газообразных веществ и, соответственно, энтропия (ΔS < 0), то при невысокой температуре ΔН >TΔS и реакция возможна в прямом направлении (ΔG < 0). При высоких температурах ΔH < TΔS и прямая реакция самопроизвольно протекать не может (ΔG > 0), а обратная реакция возможна.
5.Термохимический закон Гесса. Тепловой эффект реакции.
Закон Гесса: тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состояния веществ.
![]()
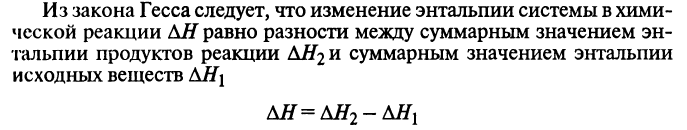
![]()
Тепловой эфффект реакции.

![]()
![]()

6.Скорость химической реакции. Закон действия масс.
Скорость химической реакции – это изменение концентрации исходного или образовавшегося в реакции вещества в единицу времени.

Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
V = k * [A] * [B], где [A] и [B] – концентрии реагирующих вещ-в А и В, k–коэфф.пропорциональности
V = k * [A]^a * [B]^b – основной постулат химической кинетики.
7.Зависимость скорости хим. реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации.
Закон Вант-Гоффа: при повышении температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза.
![]()
![]()
Уравнение Аррениуса:


8.Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.
Эффективный способ повышения скорости реакции основан на применении катализаторов.
Катализаторами называются вещества, которые увеличивают скорость химической реакции, но сами при этом не изменяются. В живом организме реакции ускоряются ферментами. Процесс ускорения реакции с помощью катализаторов называется катализом. Вещества, замедляющие реакцию, называются ингибиторами, а процесс замедления реакции – ингибированием.
Катализ различают гомогенный и гетерогенный. При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах.
Большинство биохимических превращений в организме животного являются каталитическими (ферментативными). По химической природе ферменты являются белками. Два фундаментальных свойства присущи биологическим катализаторам – специфичность катализа и способность ускорять реакцию. В живом организме имеется значтельное число различных ферментов.
