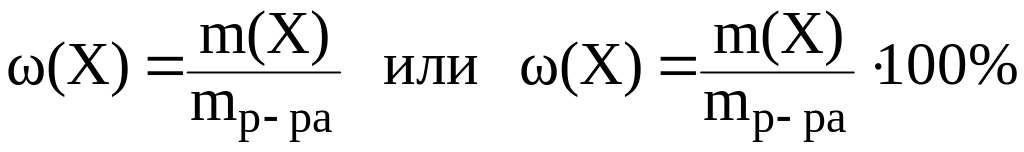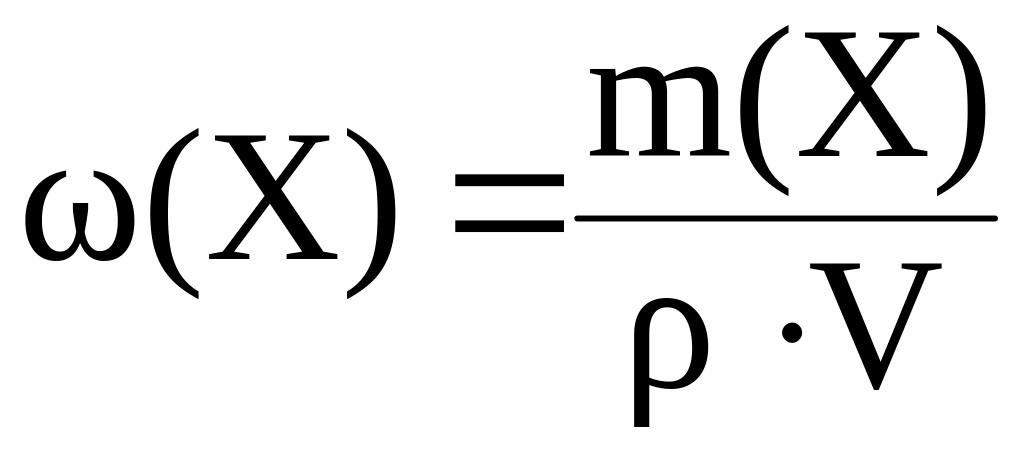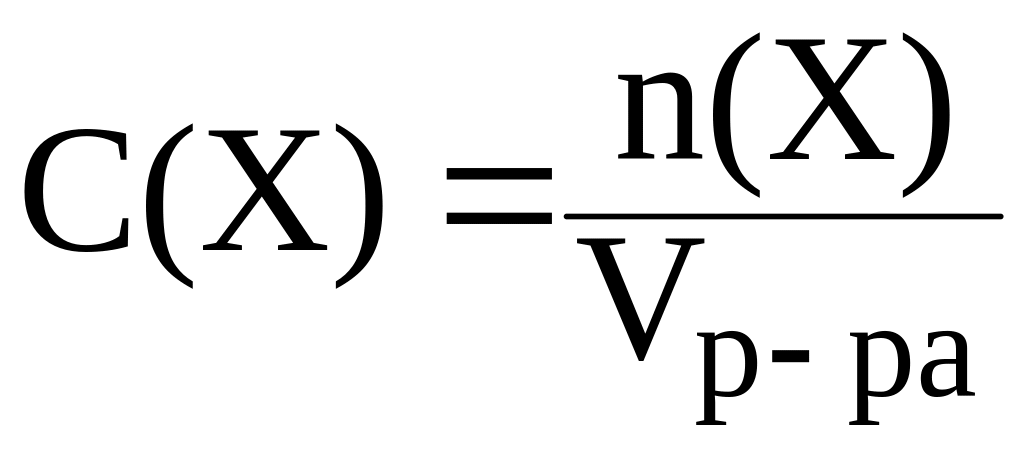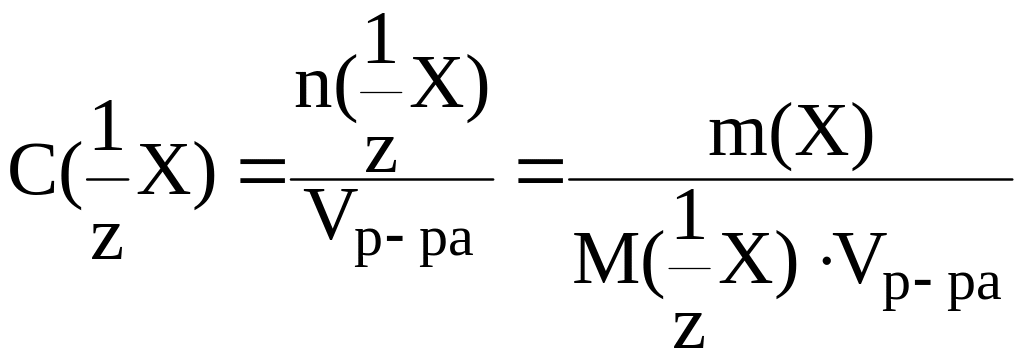- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
7.1. Основные способы выражения концентрации растворов
Количественный состав раствора чаще всего оценивают при помощи понятия концентрации, под которым понимают содержание растворенного вещества (в определенных единицах) в единице массы (объема) раствора (растворителя). Основными способами выражения концентрации растворов являются следующие:
1. Массовая доля вещества (X) это отношение массы данного компонента X, содержащегося в системе, к общей массе этой системы:
|
(19) |
Так как
![]() ,
где
плотность раствора [г/мл], V
объем раствора
[мл], то формулу (19) можно представить в
виде:
,
где
плотность раствора [г/мл], V
объем раствора
[мл], то формулу (19) можно представить в
виде:
|
(19) |
Массовая доля выражается в долях единицы или в %. Массовая доля компонента в % показывает, сколько грамм данного компонента содержится в 100 г раствора. Например, раствор NaCl с массовой долей 0,9% содержит 0,9 г NaCl в 100 г раствора.
Пример 1. Вычислить массовую долю NaCl, если 20 г NaCl растворено в 180 г Н2О.
Решение.
Сначала найдем массу раствора:
![]()
Тогда
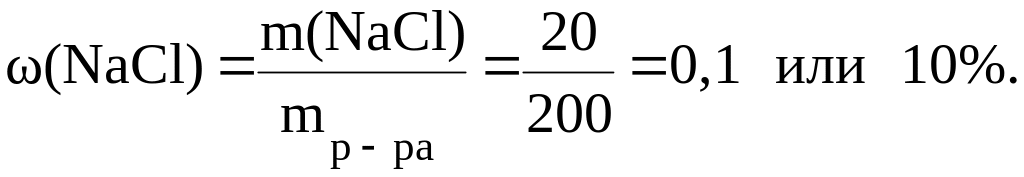
Пример 2. Найти массу NaHCO3 в 2 л 10% раствора плотностью 1,1 г/мл.
Решение.
Здесь удобно воспользоваться формулой 19:
![]() 220
г.
220
г.
2. Молярная концентрация раствора С(X) это отношение количества вещества компонента n(X) к объему раствора Vр-ра:
|
(20) |
Так как
 ,
то можем записать:
,
то можем записать:
|
(20) |
Молярная концентрация выражается в моль/л и показывает какое количество растворенного вещества (в молях) содержится в 1 л раствора.
Пример 1. Имеется 200 мл раствора H2SO4 с C(H2SO4) 0,3 моль/л. Найти n(H2SO4) в растворе.
Решение.
Из формулы (20):
![]()
Пример 2. В 500 мл раствора содержится 10,6 г Na2CO3. Вычислить C(Na2CO3).
Решение.
M(Na2CO3) 232 12 163 106 г/моль.
По формуле (20):
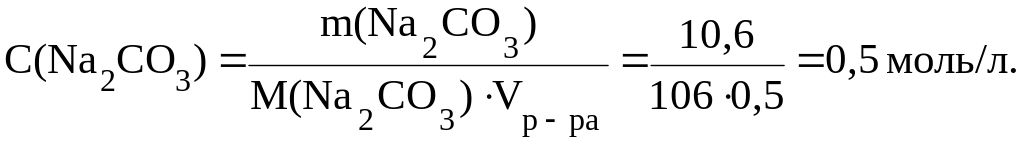
3. Молярная
концентрация эквивалента С(![]() X)
это отношение количества эквивалента
вещества n(
X)
к объему раствора Vр-ра:
X)
это отношение количества эквивалента
вещества n(
X)
к объему раствора Vр-ра:
|
(21) |
Молярная концентрация эквивалента выражается в моль/л.
Химический эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или высвобождать 1 ион водорода в кислотно-основных или ионообменных реакциях.
Так же, как молекула, атом или ион, эквивалент безразмерен.
Масса моля эквивалента называется молярной массой эквивалента М( X). Величина называется фактором эквивалентности. Она показывает, какая доля реальной частицы вещества соответствует эквиваленту. Для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой это вещество участвует, например, в реакции взаимодействия Н3РО4 с NaOH может происходить замещение одного, двух или трех протонов:
1. H3PO4 + NaOH NaH2PO4 + H2O;
2. H3PO4 + 2NaOH Na2HPO4 + 2H2O;
3. H3PO4 + 3NaOH Na3PO4 + 3H2O.
В
соответствии с определением эквивалента,
в 1-й реакции замещается один протон,
следовательно, молярная масса эквивалента
вещества равна молярной массе, т. е.
z l
и
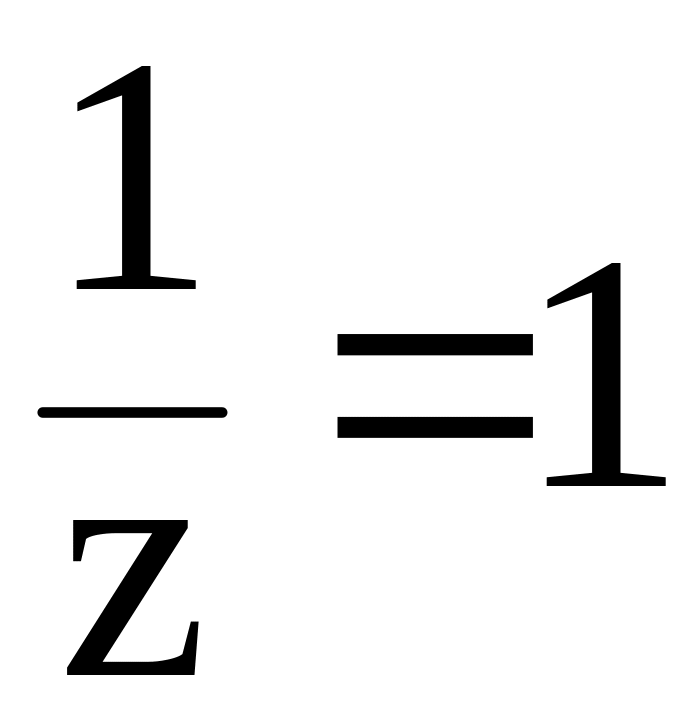 .
В данном случае:
.
В данном случае:
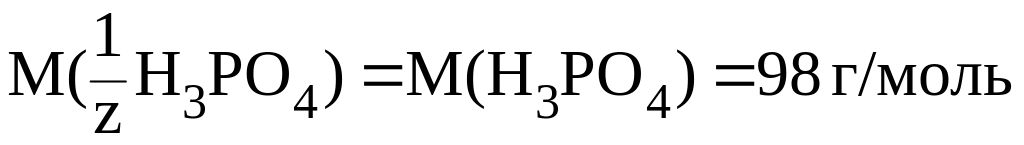 .
.
Во 2-й
реакции происходит замещение двух
протонов, следовательно, молярная масса
эквивалента составит половину молярной
массы Н3РО4,
т. e.
z 2,
а
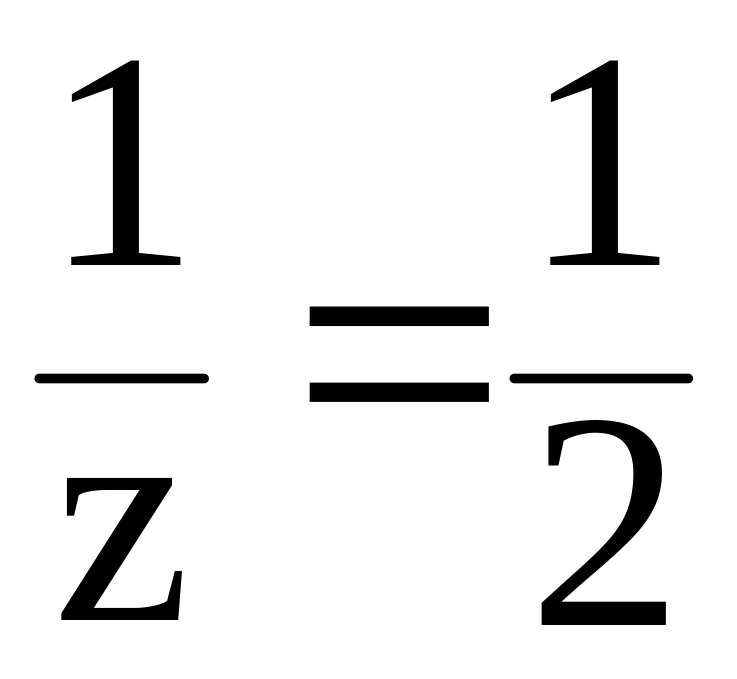 .
Здесь:
.
Здесь:
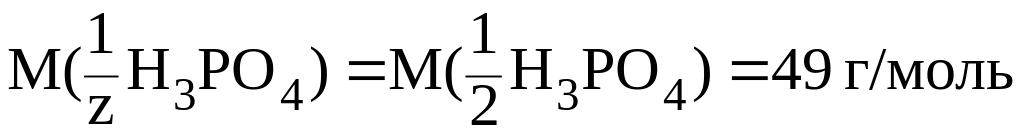 .
.
В 3-й реакции
происходит замещение трех протонов и
молярная масса эквивалента составит
третью часть молярной массы Н3РО4,
т.е. z 3,
a
 .
Соответственно:
.
Соответственно:
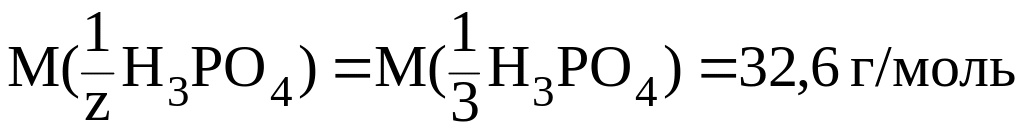 .
.
В реакциях обмена, где непосредственно не участвуют протоны, эквиваленты могут быть определены косвенным путем, введением вспомогательных реакций, анализ результатов которых позволяет вывести правило, что для всех реакций z равен суммарному заряду обменивающихся ионов в молекуле вещества, участвующего в конкретной химической реакции.
Пример 1. Найти молярную массу эквивалента AgNO3 и AlCl3, участвующих в реакции:
AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl.
В AlCl3 обменивается 1 ион Al3+ с зарядом +3, следовательно, z = 13 = 3. Таким образом:

Можно также сказать,
что обмениваются 3 иона хлора с зарядом
1.
Тогда z = 31 = 3
и
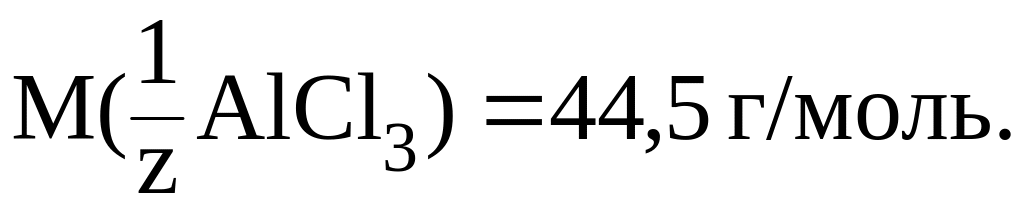
Для AgNO3 z = 11 = 1 (обменивается 1 ион Ag+ с зарядом +1 или обменивается 1 ион NO3 с зарядом 1).
Пример 2. Найти молярную массу эквивалента Al2(SO4)3, участвующего в реакции:
Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3.
Для Al2(SO4)3 z = 23 = 6 (обменивается 2 иона Al3+ с зарядом +3 или 3 иона SO42 с зарядом 2). Следовательно,
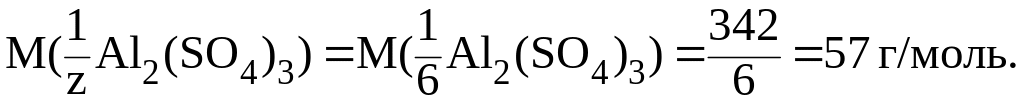
Итак,
запись С(
H2SO4)
= 0,02 моль/л означает, что имеется раствор,
в 1 л которого содержится 0,02 моль
эквивалента H2SO4,
а молярная масса эквивалента H2SO4
составляет при этом
![]() молярной массы H2SO4,
т. е. 1 л раствора содержит
молярной массы H2SO4,
т. е. 1 л раствора содержит
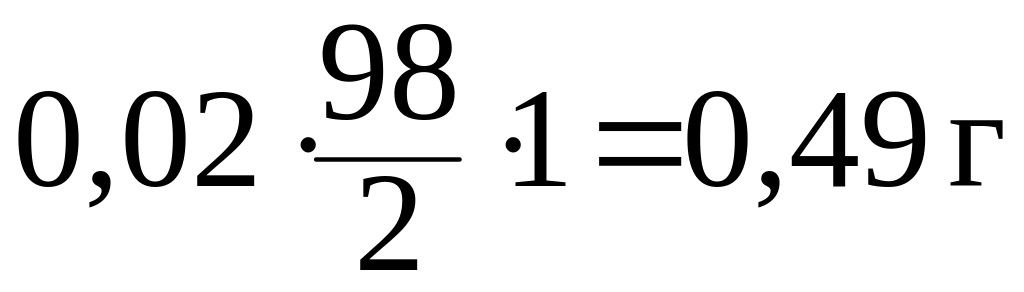 H2SO4.
H2SO4.
Если фактор эквивалентности , то молярная концентрация эквивалента равна молярной концентрации раствора.
Пример
3.
В 500 мл раствора FeС13
содержится 2,7 г соли. Найти C(![]() FeС13).
FeС13).