
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Глава 4. Строение Атома
Атом состоит из ядра и электронной оболочки. Ядро атома, в свою очередь, состоит из протонов и нейтронов. Характеристики нейтронов, протонов и электронов приведены в таблице 4.
Таблица 4. Характеристики нейтронов, протонов и электронов.
Частица |
Символ |
Заряд |
Масса |
||
Кл |
Условные единицы |
г |
а.е.м. |
||
Электрон |
e |
1,61019 |
1 |
9,11028 |
5,5104 |
Протон |
p |
+1,61019 |
+1 |
1,671024 |
1 |
Нейтрон |
n |
0 |
0 |
1,671024 |
1 |
Число протонов в ядре равно порядковому номеру элемента в периодической системе Д.И.Менделеева. Эта величина определяет заряд ядра Z и природу химического элемента. Двух элементов с одинаковым порядковым номером не бывает.
Сумма масс протонов и нейтронов соответствует массовому числу A, численно равному относительной атомной массе (или молярной массе) атома элемента. Таким образом, между зарядом ядра, массовым числом и числом нейтронов (N) существует простая взаимосвязь:
A = Z + N |
(8) |
Вид
атомов с определенными значениями A
и Z
называется нуклидом.
Нуклиды обозначают следующим образом:
в левом верхнем углу записывают значение
массового числа, в левом нижнем
заряд ядра. Например:
![]() и т.д. Нуклиды
с одинаковыми Z,
но различными A
и N,
называются изотопами:
и т.д. Нуклиды
с одинаковыми Z,
но различными A
и N,
называются изотопами:
![]() .
Таким образом, ядра изотопов содержат
различное число нейтронов. Атом любого
элемента является электронейтральной
частицей, поэтому число электронов в
атоме равно числу протонов. Частица, в
которой число электронов в атоме не
равно числу протонов, называется ион.
Ионы могут быть положительными (H+,
Cu2+,
Al3+)
и отрицательными (Cl,
S2).
При обозначении заряда иона знак заряда
ставят после его численного значения.
.
Таким образом, ядра изотопов содержат
различное число нейтронов. Атом любого
элемента является электронейтральной
частицей, поэтому число электронов в
атоме равно числу протонов. Частица, в
которой число электронов в атоме не
равно числу протонов, называется ион.
Ионы могут быть положительными (H+,
Cu2+,
Al3+)
и отрицательными (Cl,
S2).
При обозначении заряда иона знак заряда
ставят после его численного значения.
Пример
1. Определить
состав ядра, число электронов и химический
элемент, соответствующий нуклиду
![]() .
.
Решение.
Заряд ядра соответствует нижнему индексу: Z = 7. Число протонов равно порядковому номеру и одинаково для всех изотопов данного элемента, поэтому данный элемент азот. Число электронов равно числу протонов и также равно 7. Число нейтронов найдем по формуле (8):
N = A Z = 15 7 = 8.
4.1. Строение электронных оболочек атомов
В настоящее время развиты представления о двойственной природе электрона: электрон обладает свойствами и волны и частицы. Электрон может находиться в любой точке вблизи ядра, но вероятность его пребывания в разных точках околоядерного пространства неодинакова. Совокупность различных положений электрона рассматривается как электронное облако с определенной плотностью отрицательного заряда.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Орбитали атома имеют разные размеры и форму. Форму орбитали, а также движение электрона в атоме описывают при помощи четырех квантовых чисел: n, l, ml и ms.
Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать целые значения, начиная с единицы (n = 1,2,3…). Наибольшее значение n для данного атома определяется номером периода. Так для He n = 1; для Li n = 1,2; для Cu n = 1,2,3,4. Различным значениям n соответствуют различные энергетические уровни.
Побочное (орбитальное) квантовое число l определяет форму орбитали и характеризует энергетическое состояние электронов на данном энергетическом уровне. Это квантовое число также принимает целочисленные значения от 0 до n 1. Например, если n = 4, то l = 0,1,2,3.
Таким образом, в пределах одного энергетического уровня существуют один или несколько подуровней, которые отличаются энергией связи с ядром.
Этим подуровням соответствуют численные или буквенные значения орбитального квантового числа:
Значение l |
0 |
1 |
2 |
3 |
4 |
Буквенное обозначение |
s |
p |
d |
f |
g |
Орбитали различных подуровней имеют разную форму: s-орбиталь форму шара, p-орбиталь форму гантели и т.д.
|
|
Рис. 1а. Форма s-орбитали. |
Рис. 1б. Форма р-орбитали. |
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и принимает значения от l до +l, включая 0. Так, если l = 1, то ml = 1; 0; +1. Ориентация орбиталей в пространстве выглядит следующим образом: электронные облака вытянуты по осям x, y и z, перпендикулярным друг другу (рис. 2).
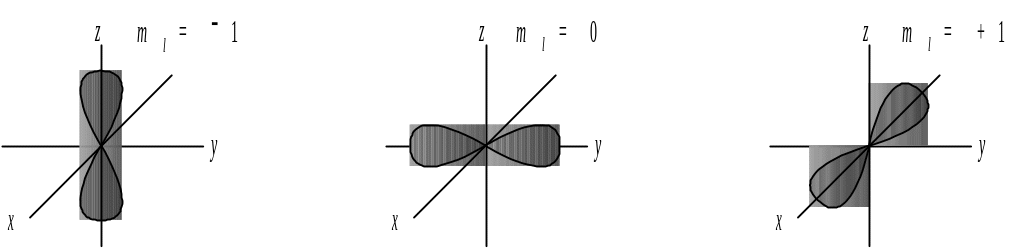
Рис. 2. Ориентация p-орбиталей в пространстве.
Спиновое квантовое число ms характеризует собственный момент импульса электрона (спин), не связанный с движением электрона в пространстве. Абсолютное значение спина всегда равно ½. Проекция спина на ось z (ms) может принимать лишь два значения: +½ и ½.
